题目内容
9.向物质的量相等的硫酸铝和硫酸铵溶于水形成的混合溶液中逐滴加入氢氧化钠溶液直至过量.下列表示氢氧化钠溶液加入的体积(X)与溶液中沉淀的量(Y)的关系示意图中正确的是( )| A. | 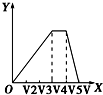 | B. | 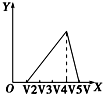 | C. | 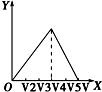 | D. | 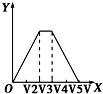 |
分析 假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol,开始滴加同时发生反应为:Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol;
然后发生反应:NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH;
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,物质的量之比等于体积之比,据此结合图象进行判断.
解答 解:假定溶液中含有Al2(SO4)3,(NH4)2SO4的物质的量分别为1mol,
开始滴加NaOH发生反应为:Al3++3OH-=Al(OH)3↓,沉淀逐渐增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,沉淀量达最大值;
然后发生反应为:NH4++OH-=NH3?H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;
最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH.
三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1,
A.由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象A符合,故A正确;
B.离子反应的顺序错误,图为先与铵根离子反应,不符合反应过程,故B错误;
C.未画出铵根离子的反应、生成氢氧化铝沉淀与氢氧化铝溶解消耗的氢氧化钠得到物质的量不符合,故C错误;
D.三阶段消耗NaOH溶液的体积比为3:1:1,图中比例不符合,故D错误;
故选A.
点评 本题考查铝化合物的性质及计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,明确反应原理为解题的关键,注意NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应.

| A. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 向煮沸的1 mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子相同 | |
| C. | 酸性H3WO4>HXO3 | |
| D. | Y元素的非金属性比W元素的非金属性强 |
| A. | 48g O3气体含O3分子数为NA | |
| B. | 2g氢气所含氢原子数目为NA | |
| C. | 常温常压下,22.4L Cl2含有的分子数为NA | |
| D. | 标准状况下,22.4L H2O的分子数为NA |
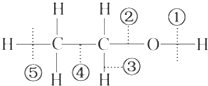
| A. | 和金属钠反应时键①断裂 | |
| B. | 在铜催化共热下与O2反应时断裂①和③ | |
| C. | 在浓H2SO4催化共热下与CH3COOH反应时断裂② | |
| D. | 在空气中完全燃烧时断裂①②③④⑤ |
| A. | x+y=7 | B. | x+y=9 | C. | x+y=5 | D. | x+y=11 |
