题目内容
19.元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.元素Z的原子最外层电子数是其内层的3倍.元素Q在第二周期且p轨道半充满.(1)Y、Z、Q三种原子的第一电离能的由大到小的关系N>O>S.
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是sp3.
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是水分子与乙醇分子之间形成氢键.
(4)Y与Z可形成YZ42-,YZ42-的空间构型为正四面体(用文字描述).
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为16NA.1mol该配合物与足量的AgNO3反应产生沉淀的物质的量为2mol.
分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素Q在第二周期且p轨道半充满,为N元素,以此解答该题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素Q在第二周期且p轨道半充满,为N元素,
(1)同主族元素从到下,第一电离能逐渐减小,则S<O,N原子最外层为半充满状态,电离能N>O,则为N>O>S,故答案为:N>O>S;
(2)H2S分子中,S原子的价层电子数=$\frac{6+2}{2}$=4,所以S原子的轨道的杂化类型是sp3杂化,
故答案为:sp3;
(3)H2O在乙醇中的溶解度大于H2S,其原因是水分子与乙醇分子之间形成氢键,
故答案为:水分子与乙醇分子之间形成氢键;
(4)SO42-中S原子的价层电子数=4+$\frac{1}{2}$(6+2-4×2)=4,且没有孤电子对,所以是正四面体结构,
故答案为:正四面体;
(5)锌的氯化物与氨水反应可形成配合物[Zn(NH3)4]Cl2,在该化合物中,锌离子与氨分子之间形成4个配位键,每个氨分子内部有三个共价键,所以1mol该配合物中含有σ键的数目为16NA,[Zn(NH3)4]Cl2中氯离子为外界离子,1mol配合物可电离出2mol氯离子,则1mol该配合物与足量的AgNO3反应产生沉淀的物质的量为2mol,
故答案为:16NA;2mol.
点评 本题原子结构与元素周期率,为高考常见题型,侧重于学生的分析能力和计算能力的考查,主要考查了原子杂化方式、氢键、分子或离子的空间构型、配合物、等知识点,中等难度,元素推断是解题的关键.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | 乙烯的结构简式:CH2CH2 | B. | CH4分子的比例模型: | ||
| C. | 羟基的电子式: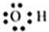 | D. | CCl4的电子式: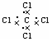 |
| 选项 | 实验事实 | 结论 |
| A | 将SO2通入含HClO的溶液中生成H2SO4 | HClO的氧化性比H2SO4强 |
| B | 向溶液X中先滴加稀硝酸,再滴加BaCl2,出现白色沉淀 | 溶液X中一定含有SO42- |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 将SO2通入溴水中,溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和Agl固体的悬浊液:c(Ag+)>c(Cl-)>(I-) | |
| C. | 25℃时,NH4Cl溶液的KN大于100℃时NaCl溶液的KN | |
| D. | 1g氢气燃烧生成液态水,放出的热量为142.9kJ.故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-285.8kJ•mol-1 |
| A. | 电解时以纯铜作阳极 | |
| B. | 电解时阳极发生还原反应 | |
| C. | 纯铜连接电源负极,电极反应是Cu-2e-=Cu2+ | |
| D. | 电解后,电解槽底部会形成含少量Ag、Au等金属阳极泥 |
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组充分反应后铝的物质的量为0.01mol |
| A. | 在水玻璃中通入过量二氧化碳,加热蒸干,最终得到混合物 | |
| B. | 铁件镀铜的目的是利用电化学防腐原理保护铁件不受腐蚀 | |
| C. | 制糖工业用活性炭脱色和制纸工业用次氯酸盐漂白纸浆的原理相同 | |
| D. | 使红色石蕊试纸变蓝的溶液中能大显存在Na+、Fe3+、NO3-、Cl- |