题目内容
已知反应2HI(g)═H2(g)+I2(g)在T℃下的平衡常数为0.01.T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
请计算回答下列问题(写出计算过程,否则不得分):
(1)起始加入HI的物质的量 mol.
(2)达到平衡后HI的物质的量浓度 mol?L-1(请保留三位有效数字).
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1:4,计算平衡时HI的体积分数为 ,以及开始时H2(g)与I2(g)的体积比为 .
| 物质 | HI | H2 | I2 |
| 浓度/(mol?L-1) | 0.40 | 0.60 | 0.60 |
(1)起始加入HI的物质的量
(2)达到平衡后HI的物质的量浓度
(3)T℃时,在另一个体积一定的密闭容器中,将I2(g)与H2(g) 置于其中发生上述反应,若达到平衡时H2(g)与I2(g)的体积比为1:4,计算平衡时HI的体积分数为
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)物质的变化量与化学计量数成正比,某时刻,HI的浓度变化量为
-0.4,H2的浓度变化量为0.60;
(2)根据三段式计算出平衡浓度,根据化学平衡常数计算公式计算;
(3)根据化学平衡三段式计算,平衡时平衡时HI的体积分数=
×100%.
| x |
| 2 |
(2)根据三段式计算出平衡浓度,根据化学平衡常数计算公式计算;
(3)根据化学平衡三段式计算,平衡时平衡时HI的体积分数=
| HI的体积 |
| 气体总体积 |
解答:
解:(1)假设起始加入的HI的物质的量为x,浓度为
,某时刻,HI的浓度为0.40,所以HI的浓度变化量为
-0.4,H2的浓度变化量为0.60,根据2HI(g)═H2(g)+I2(g),(
-0.4):0.60=2:1,解得x=3.2;
故答案为:3.2;
(2)假设达到平衡后HI的物质的量浓度为y,HI的起始浓度为
=1.6mol/L,
2HI(g)?H2(g)+I2(g)
起始(mol?L-1) 1.6 0 0
变化(mol?L-1) 1.6-y
(1.6-y)
(1.6-y)
平衡(mol?L-1) y
(1.6-y)
(1.6-y)
平衡常数K=
=
=0.01,解得y=1.33,
故答案为:1.33;
(3)2HI(g)?H2(g)+I2(g)的平衡常数为0.01,所以H2(g)+I2(g)?2HI(g)的平衡常数K=100,假设开始时H2(g)与I2(g)的物质的量分别为2a、2b,平衡时生成HI物质的量为4c,
H2(g)+I2(g)?2HI(g)
起始(mol?L-1) a b 0
变化(mol?L-1) c c 2c
平衡(mol?L-1) a-c b-c 2c
化学平衡常数K=
=
=100 ①,
根据n=
,知道物质的量之比等于体积之比,2(a-c):2(b-c)=1:4 ②,
由①②联立解得2a:2b=11:14
平衡时平衡时HI的体积分数=
×100%=
×100%=80%.
故答案为:80%;11:14.
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
故答案为:3.2;
(2)假设达到平衡后HI的物质的量浓度为y,HI的起始浓度为
| 3.2mol |
| 2L |
2HI(g)?H2(g)+I2(g)
起始(mol?L-1) 1.6 0 0
变化(mol?L-1) 1.6-y
| 1 |
| 2 |
| 1 |
| 2 |
平衡(mol?L-1) y
| 1 |
| 2 |
| 1 |
| 2 |
平衡常数K=
| c(I2)?c(H2) |
| c2(HI) |
| ||||
| y2 |
故答案为:1.33;
(3)2HI(g)?H2(g)+I2(g)的平衡常数为0.01,所以H2(g)+I2(g)?2HI(g)的平衡常数K=100,假设开始时H2(g)与I2(g)的物质的量分别为2a、2b,平衡时生成HI物质的量为4c,
H2(g)+I2(g)?2HI(g)
起始(mol?L-1) a b 0
变化(mol?L-1) c c 2c
平衡(mol?L-1) a-c b-c 2c
化学平衡常数K=
| c2(HI) |
| c(H2)?c(I2) |
| (2c)2 |
| (a-c)?(b-c) |
根据n=
| V |
| Vm |
由①②联立解得2a:2b=11:14
平衡时平衡时HI的体积分数=
| HI的体积 |
| 气体总体积 |
| 2×2c |
| 2[(a-c)+(b-c)+2c] |
故答案为:80%;11:14.
点评:本题考查化学平衡的计算,题目难度中等,把握平衡常数的含义与运用是解答该题的关键之处,答题时注意领悟该题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
实验中需用2.0mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( )
| A、95mL;201.4g |
| B、500mL;100.7g |
| C、1000mL;201.4g |
| D、1000mL;212.0g |
中共十八大提出“生态文明”的新理念,下列做法不符合该理念的是( )
| A、研究可降解高分子材料,较少使用塑料制品 |
| B、倡导低碳经济,减少对化石燃料的依赖 |
| C、通过燃煤固硫、汽车尾气净化提高空气质量 |
| D、采用露天焚烧或深埋的方法处理所有垃圾 |
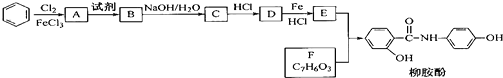
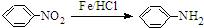 .请回答下列问题:
.请回答下列问题: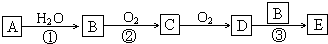
 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.