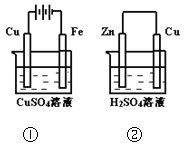
��Ŀ����
����Ŀ����������(NaN3)����������ˮ�������Ҵ������������ѣ���������ȫ�����е���Ҫ�ɷ֣����ڷ�����ײ��˲��ֽ������������ʹ���ҹ���
��֪��![]() ��
��
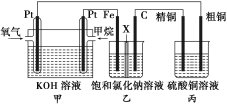
ʵ����������ͼװ��ģ�ҵ��NaN3�Ʊ���

ʵ�������Ʊ�NaN3
(1)װ��C��ʢ�ŵ�ҩƷΪ____________��װ��B����Ҫ������__________________��
(2)Ϊ��ʹa�����������ȣ�װ��D�н�����ԡ������ˮԡ����Ҫԭ����______________��
(3)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽ____________________________________��
(4)N2O����NH4NO3(�۵�169.6��)��240��ֽ��Ƶã�Ӧѡ������巢��װ����________��

ʵ�����������ᴿ
�����ᴿ��Ӧ��ȫ������ȡ��װ��D�еĻ����������²������õ�NaN3���塣

(5)��֪��NaNH2����ˮ��Ӧ����NaOH�Ͱ���������������__________ϴ�ӣ���ԭ����_____________��
ʵ�����������ⶨ
ʵ�����õζ����ⶨ����������Ʒ��NaN3������������
�ٽ�2.500g�������500.00mL��Һ��
��ȡ50.00mL��Һ����ƿ�У�����50.00mL 0.1010![]() (NH4)2Ce(NO3)6 ��Һ��
(NH4)2Ce(NO3)6 ��Һ��
�۳�ַ�Ӧ����Һ��ϡ�ͣ�����Һ�м���8mLŨ���ᣬ����3���ڷƆ���ָʾҺ��0.0500![]() (NH4)2Fe(SO4)2����Һ�ζ�������Ce4+�����ı���Һ�����Ϊ29.00mL���ⶨ�������漰�ķ�Ӧ����ʽ���£�2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����Ce4++Fe2+=Ce3++Fe3+
(NH4)2Fe(SO4)2����Һ�ζ�������Ce4+�����ı���Һ�����Ϊ29.00mL���ⶨ�������漰�ķ�Ӧ����ʽ���£�2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����Ce4++Fe2+=Ce3++Fe3+
(6)���Ƶ���������Һʱ�����ձ�������������Ͳ�⣬����Ҫ�õ��IJ���������___________��������������ȷ���ζ����յ���ȡ�ζ�����(NH4)2Fe(SO4)2����Һ���ʱ���ӣ����������ⶨ��Ʒ�е���������������__________(ѡ�ƫ����ƫС�����䡱)��
(7)������NaN3����������Ϊ___________��(������λ��Ч����)
���𰸡���ʯ�� ��������������е�ˮ ��Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��� 2Na+2NH3![]() 2NaNH2+H2�� �� ���� NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��� 500mL����ƿ����ͷ�ι� ƫ�� 93.60%
2NaNH2+H2�� �� ���� NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��� 500mL����ƿ����ͷ�ι� ƫ�� 93.60%
��������
ʵ��I��Aװ��Ϊ��ȡ������װ�ã�Bװ��������������������е�ˮ��Cװ��Ϊ���ﰱ������Ϊ��������(NaN3)����������ˮ�����Ա��뱣֤���ﻷ����Dװ��Ϊ��ȡ��������(NaN3)��װ�á���Ӧ֮ǰ��Ҫ�ų�װ���ڵĿ�������ֹNa������е�����������Ӧ��Ӱ����ʣ�ͬʱӦ����β������װ�ã��ݴ˷������(1)��(4)��
ʵ��II������(NaN3)����������ˮ�������Ҵ������������ѣ��������(5)��
ʵ����������������Һ�IJ����ʹ�õ�������ϵζ��������������ķ������(6)��
(7)��ϵζ����̣��������ƺ���������立�Ӧ����0.0500molL-1(NH4)2Fe(SO4)2(���������)����Һ�ζ�������Ce4+����ϻ�ѧ����ʽ������ϵ���㡣
(1)��������������Ũ��ˮ�ֽ�����İ����к��н϶��ˮ��������Bװ�÷������ˮ����������������ˮ��������װ��CΪ���ﰱ����װ�ã����еĸ��������ѡ�ü�ʯ�ң�Bװ��������������������е�ˮ���ʴ�Ϊ����ʯ�ң���������������е�ˮ��
(2) װ��D�еķ�Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��£������Ҫ��ԡ���ʴ�Ϊ����Ӧ��Ҫ��210����220���½��У�ˮԡ���ܴﵽ�����ĸ��£�
(3)�������ۻ����Ʒ�Ӧ����NaNH2�Ļ�ѧ����ʽΪ2Na+2NH3![]() 2NaNH2+H2�����ʴ�Ϊ��2Na+2NH3
2NaNH2+H2�����ʴ�Ϊ��2Na+2NH3![]() 2NaNH2+H2����
2NaNH2+H2����
(4)N2O����NH4NO3(�۵�169.6��)��240���ֽ��Ƶã�NH4NO3�ֽ�ʱ�Ѿ��ڻ���ͬʱ�ֽ�����л�����ˮ��Ϊ�˷�ֹˮ�������Թܵײ���ʹ�Թ�ը�ѣ��Թܿ���Ҫ��������б������Ҫ��ֹNH4NO3���£�ֻ��װ��������Ҫ�ʴ�Ϊ������
(5) NaN3���岻�������ѣ����������Բ�������ϴ�ӣ��ܼ���NaN3��ʧ��ͬʱϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ���ʴ�Ϊ�����ѣ�NaN3���岻�������ѣ��ܼ�������ʧ����ϴȥ������Ҵ����ʣ��������ӷ��������ڲ�Ʒ���ٸ��
(6)���Ƶ���������Һʱ�������õ��ձ�������������Ͳ�⣬����Ҫ�õ��IJ���������500mL����ƿ����ͷ�ιܣ�������������ȷ���ζ����յ��ȡ�ζ�����(NH4)2Fe(SO4)2����Һ���ʱ���ӣ��������ı�Һ�����ƫС����(NH4)2Ce(NO3)6�����ʵ���ƫ���������ⶨ��Ʒ�е���������������ƫ�ʴ�Ϊ��500mL����ƿ����ͷ�ιܣ�ƫ��
(7)50.00 mL 0.1010 molL-1(NH4)2Ce(NO3)6 ��Һ�У�n[(NH4)2Ce(NO3)6]=0.1010molL-1��50.00��10-3L=5.05��10-3mol��
29.00mL 0.0500 molL-1(NH4)2Fe(SO4)2����Һ�У�n[(NH4)2Fe(SO4)2]=0.0500molL-1��29.00��10-3L=1.45��10-3mol��
����Ce4++Fe2+=Ce3++Fe3+��֪��(NH4)2Fe(SO4)2����(NH4)2Ce(NO3)6�����ʵ���Ϊ1.45��10-3mol��
����NaN3��Ӧ��n[(NH4)2Ce(NO3)6]=5.05��10-3mol-1.45��10-3mol=3.6��10-3mol��
����2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2����֪��n(NaN3)=n[(NH4)2Ce(NO3)6]=3.6��10-3mol����500.00mL��Һ��(2.500g������)n(NaN3)=3.6��10-3mol��![]() =0.036mol��������NaN3������������=
=0.036mol��������NaN3������������=![]() ��100%=93.60%���ʴ�Ϊ��93.60%��
��100%=93.60%���ʴ�Ϊ��93.60%��