题目内容
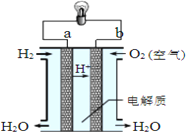
【题目】臭氧是常见的强氧化剂,广泛用于水处理系统。制取臭氧的方法很多,其中高压放电法和电解纯水法原理如下图所示。下列有关说法错误的是

A. 两种方法都是电解原理
B. 高压放电出来的空气中,除含臭氧外还含有氮的氧化物
C. 电解纯水时,电极b发生的电极反应有3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+
D. 电解纯水时,H+由电极b经聚合固体电解质膜流向电极a
【答案】A
【解析】
从题干叙述中分析制取臭氧有两种方法,从电解的原理分析电极反应及电解质溶液中离子的流向。
A.在高压放电的条件下,O2生成O3,并非电解原理,故A错误;
B.由于在放电的条件下氧气也与氮气化合生成NO,而NO可以被氧化生成NO2,所以高压放电出来的空气中,除含臭氧外还含有氮的氧化物,故B正确;
C.根据装置图可知,b电极生成氧气和臭氧,这说明b电极是阳极,水电离出的OH-放电,电极反应式为3H2O-6e-=O3↑+6H+和2H2O-4e-=O2↑+4H+,故C正确;
D.a电极是阴极,水电离出的氢离子放电生成氢气,所以电解时,H+由电极b经聚合固体电解质膜流向电极a,D正确。
故选A。

练习册系列答案
相关题目