题目内容
19.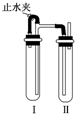 实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.
实验室制备Fe(OH)2沉淀时,由于其在空气中极易发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3.(填化学方程式)而很难观察到沉淀的颜色.为制得Fe(OH)2白色沉淀,有人设计了如图所示的装置,用NaOH溶液、铁屑、稀H2SO4等试剂制备.实验时试管Ⅰ里应加入稀H2SO4和铁屑(填试剂名称).在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.
分析 Fe(OH)2易在空气中被氧化生成Fe(OH)3,制备Fe(OH)2,应将装置内的空气排除,可用铁和稀硫酸反应生成氢气和硫酸亚铁,利用氢气排尽空气,将硫酸亚铁排入到氢氧化钠溶液中可生成Fe(OH)2,以此解答该题.
解答 解:Fe(OH)2易在空气中被氧化生成Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,制备Fe(OH)2,应将装置内的空气排除,可用铁和稀硫酸在试管Ⅰ反应生成氢气和硫酸亚铁,利用氢气排尽空气,当检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹,将硫酸亚铁排入到氢氧化钠溶液中可生成Fe(OH)2,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;稀H2SO4和铁屑;检验试管Ⅱ出口处排出的H2的纯度,当排出的H2已经纯净时再夹紧止水夹.
点评 本题考查了氢氧化亚铁的制备,侧重于学生的分析能力和实验能力的考查,为防止氢氧化亚铁被氧化,要将空气中氧气排出,使亚铁离子和氢氧根离子在无氧条件下反应来制备氢氧化亚铁,难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.下列说法正确的是( )
| A. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| B. | 乙醇和乙醛均能发生氧化反应生成乙酸 | |
| C. | 乙醇、乙烷都可以与钠反应生成氢气 | |
| D. | 乙醇和乙酸都能与氢氧化钠发生中和反应 |
10.下列叙述中正确的是( )
| A. | 氯化钠中混有少量单质碘杂质,可用升华的方法提纯 | |
| B. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| C. | SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| D. | 浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥 |
7.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol/LNaHSO4溶液中含有HSO4-总数为0.1NA | |
| B. | 16g16O2和18 g18O2中含有的质子数均为8NA | |
| C. | 1 mol Fe与足量的稀硝酸反应,转移电子数为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水所得溶液中含有的氯离子数为0.1NA |
14.我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi $?_{充电}^{放电}$LixV2O5.下列说法中,正确的是( )
| A. | 锂在放电时做正极材料,充电时为阳极材料 | |
| B. | 电池在放电时,Li+向负极移动 | |
| C. | 该电池充电时阳极的反应为:LixV2O5-xe-=V2O5+xLi+ | |
| D. | V2O5只是锂发生反应的载体,不参与电池反应 |
4.下列有关一定物质的量浓度溶液的配制说法正确的是( )
| A. | 将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液 | |
| B. | 稀释硫酸时,往装有浓硫酸的烧杯中注入水 | |
| C. | 用托盘天平称取10.600 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| D. | 容量瓶中残留少量蒸馏水时,无需干燥,对配制的结果没有影响 |
11.下列结论中错误的是( )
①微粒半径:K+>Al3+>Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:F->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①微粒半径:K+>Al3+>Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:F->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ① | B. | ①③ | C. | ②④⑤⑥⑦ | D. | ①③⑤ |
9.下列各组物质的主要成分皆为同一种酸所对应的盐的是( )
| A. | 大理石 钡餐 石膏 | B. | 小苏打 苏打 水玻璃 | ||
| C. | 芒硝 胆矾 明矾 | D. | 黄铜矿 硫铁矿 磁铁矿 |