题目内容
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A、NH4Cl
| ||||
| B、NH3+CO2+H2O═NH4HCO3 | ||||
| C、2NaOH+Cl2═NaCl+NaClO+H2O | ||||
| D、2Na2O2+2CO2═2Na2CO3+O2 |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属元素之间形成非极性共价键,化学变化中一定含化学键断裂和生成,以此来解答.
解答:
解:A.无非极性键的断裂和形成,故A不选;
B.无非极性键的断裂和形成,故B不选;
C.有非极性键(Cl-Cl)的断裂但无非极性键的形成,故C不选;
D.Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,O2中有非极性共价键,时有离子键、极性共价键和非极性共价键的断裂和形成,故D选;
故选D.
B.无非极性键的断裂和形成,故B不选;
C.有非极性键(Cl-Cl)的断裂但无非极性键的形成,故C不选;
D.Na2O2既有离子键又有非极性共价键,CO2中有极性共价键,O2中有非极性共价键,时有离子键、极性共价键和非极性共价键的断裂和形成,故D选;
故选D.
点评:本题以四个化学反应为载体综合考查了学生对离子键、极性共价键和非极性共价键的认识程度,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
把500ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、10(b-2a) mol?L-1 |
 对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )| A、增大b的浓度 | B、升高温度 |
| C、加入催化剂 | D、增大压强 |
已知有机反应RH+Cl2(气)
RCl(液)+HCl(气),若在农药和有机合成工业中将HCl转化副产品盐酸,则从上述反应产物中分离得到盐酸的最佳方法是( )
| 光 |
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
| A、Na+、Ag+、CO32-、Cl- |
| B、K+、Ba2+、SO42-、Cl- |
| C、Na+、K+、CO32-、Cl- |
| D、H+、K+、Cl-、HCO3- |
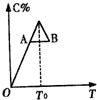 对于反应2A+B?2C的反应过程中C的百分含量随温度变化如图所示,则:
对于反应2A+B?2C的反应过程中C的百分含量随温度变化如图所示,则: 有机物间存在如下转化关系:
有机物间存在如下转化关系: