题目内容
生产自来水的流程如图所示:回答下列问题.
(1)FeSO4.7H2O是常用的絮凝剂,它在水中最终生成 沉淀(填化学式).
(2)天然水中含有较多的钙、镁离子,称为硬水.生活中常用 方法来降低水的硬度.
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是 .
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式 .
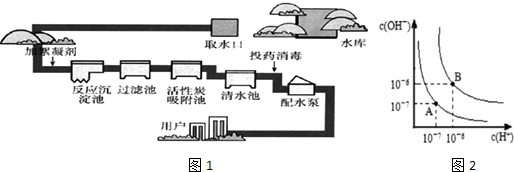
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol.L-1 的NaOH溶液中,由水电离出的c(H+)= 1mol.L-1,Kw(25℃) Kw(100℃)(填“>”“<”或“=”).
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有 (填字母).
A.溶液中一直存在:c(H+)=c(CH3COO-)+c(OH-)
B.加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C.加入过程中,溶液中所有离子浓度逐渐增大
D.加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂.

(1)FeSO4.7H2O是常用的絮凝剂,它在水中最终生成
(2)天然水中含有较多的钙、镁离子,称为硬水.生活中常用
(3)过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是
(4)“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式
(5)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
①100℃时1mol.L-1 的NaOH溶液中,由水电离出的c(H+)=
②25℃时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有
A.溶液中一直存在:c(H+)=c(CH3COO-)+c(OH-)
B.加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C.加入过程中,溶液中所有离子浓度逐渐增大
D.加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂.
考点:物质分离和提纯的方法和基本操作综合应用,胶体的重要性质,弱电解质在水溶液中的电离平衡,水的电离,过滤
专题:
分析:(1)亚铁离子易被氧化为铁离子;
(2)加热煮沸能使钙、镁离子转化为沉淀;
(3)根据过滤的操作分析;
(4)氯气与石灰乳反应生成漂白粉;
(5)①根据图2计算100℃时Kw,再计算水电离出的c(H+);水的电离是吸热过程;
②A.溶液中存在电荷守恒;
B.醋酸的浓度越大,其电离程度越小;
C.溶液中氢离子浓度增大,氢氧根离子浓度减小;
D.升高温度促进醋酸的电离;
E.NaOH与醋酸溶液反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂.
(2)加热煮沸能使钙、镁离子转化为沉淀;
(3)根据过滤的操作分析;
(4)氯气与石灰乳反应生成漂白粉;
(5)①根据图2计算100℃时Kw,再计算水电离出的c(H+);水的电离是吸热过程;
②A.溶液中存在电荷守恒;
B.醋酸的浓度越大,其电离程度越小;
C.溶液中氢离子浓度增大,氢氧根离子浓度减小;
D.升高温度促进醋酸的电离;
E.NaOH与醋酸溶液反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂.
解答:
解:(1)FeSO4.7H2O是常用的絮凝剂,它在水中电离出亚铁离子易被氧化为铁离子,最终生成Fe(OH)3,故答案为:Fe(OH)3;
(2)天然水中含有较多的钙、镁离子,称为硬水,加热煮沸能使钙、镁离子转化为碳酸钙、氢氧化镁沉淀,从而降低水的硬度,故答案为:煮沸;
(3)过滤时用玻璃棒引流,用烧杯盛放滤液,漏斗为过滤器,所以用到的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:漏斗、烧杯、玻璃棒;
(4)氯气与石灰乳反应生成漂白粉,其反应的方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)①由图2可知,100℃时Kw=c(H+)?c(OH-)=10-6×10-6=10-12,1mol.L-1 的NaOH溶液中,由水电离出的c(H+)=
=
=10-12mol.L-1;水的电离是吸热过程,温度越高水的电离程度越大,Kw越大,所以Kw(25℃)<Kw(100℃);
故答案为:10-12;<;
②A.溶液中存在电荷守恒,即溶液中一直存在:c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.加入过程中,醋酸的浓度越大,其电离程度越小,所以醋酸的电离程度逐渐减小,氢离子浓度增大,水的电离程度减小,故B错误;
C.溶液中Kw=c(H+)?c(OH-)为常数,氢离子浓度增大,则氢氧根离子浓度减小,故C错误;
D.升高温度促进醋酸的电离,所以加完冰醋酸后,若升高烧杯温度,醋酸电离出的氢离子浓度增大,则溶液pH值降低,故D正确;
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,NaOH与醋酸反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂,所以应该选用酚酞作指示剂;故E错误.
故答案为:AD.
(2)天然水中含有较多的钙、镁离子,称为硬水,加热煮沸能使钙、镁离子转化为碳酸钙、氢氧化镁沉淀,从而降低水的硬度,故答案为:煮沸;
(3)过滤时用玻璃棒引流,用烧杯盛放滤液,漏斗为过滤器,所以用到的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:漏斗、烧杯、玻璃棒;
(4)氯气与石灰乳反应生成漂白粉,其反应的方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)①由图2可知,100℃时Kw=c(H+)?c(OH-)=10-6×10-6=10-12,1mol.L-1 的NaOH溶液中,由水电离出的c(H+)=
| Kw |
| c(OH-) |
| 10-12 |
| 1 |
故答案为:10-12;<;
②A.溶液中存在电荷守恒,即溶液中一直存在:c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.加入过程中,醋酸的浓度越大,其电离程度越小,所以醋酸的电离程度逐渐减小,氢离子浓度增大,水的电离程度减小,故B错误;
C.溶液中Kw=c(H+)?c(OH-)为常数,氢离子浓度增大,则氢氧根离子浓度减小,故C错误;
D.升高温度促进醋酸的电离,所以加完冰醋酸后,若升高烧杯温度,醋酸电离出的氢离子浓度增大,则溶液pH值降低,故D正确;
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,NaOH与醋酸反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂,所以应该选用酚酞作指示剂;故E错误.
故答案为:AD.
点评:本题考查了物质分离和提纯操作、实验仪器的选择、溶液中离子浓度的计算、弱电解质的电离平衡等,题目难度中等,侧重于基础知识的综合应用的考查,注意把握Kw在计算中的应用.

练习册系列答案
相关题目
下表是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8.下列说法错误的是( )
| X | Y | ||
| Z | W |
| A、Z的气态氢化物比W的气态氢化物稳定 |
| B、原子半径由大到小的顺序为:X>Y |
| C、X元素只能形成一种单质 |
| D、Y元素可形成多种氧化物 |
下列装置或操作能达到实验目的是( )
A、 检查装置气密性 |
B、 从碘的CCl4溶液中分离出碘 |
C、 除去甲烷中乙烯 |
D、 分离甲苯与乙醇 |
下列图示实验正确的是( )
A、 分离二氧化锰和氯化锰溶液 |
B、 碳酸氢钠受热分解 |
C、 除去CO气体中的CO2气体 |
D、 配置一定物质的量浓度的溶液 |
 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考如图所示从下表中选出正确选项( ) | 选项 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
| A | 碱 | 酸 | 石蕊 | 甲 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 乙 |
| D | 酸 | 碱 | 酚酞 | 乙 |
| A、A | B、B | C、C | D、D |
下列叙述中错误的是( )
| A、一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al+)<c(Na+)<c(Cl-) |
| C、在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
| D、在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
 A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答:
A、B、M、D、E是原子序数依次增大的五种短周期元素.A元素的一种原子中不含中子.B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍.试回答: