题目内容
BaCl2剧毒,致死量为0.3g,万一不慎误服,应按第7题的处理外,还应服用适量解毒剂,此解毒剂应是( )
| A、AgNO3 |
| B、CuSO4 |
| C、Na2CO3 |
| D、MgSO4 |
考点:硫酸盐
专题:
分析:A.银离子有毒;
B.铜离子有毒;
C.碳酸钡能与胃酸反应生成氯化钡;
D.硫酸镁能与氯化钡反应生成硫酸钡沉淀,且硫酸钡与胃酸不反应.
B.铜离子有毒;
C.碳酸钡能与胃酸反应生成氯化钡;
D.硫酸镁能与氯化钡反应生成硫酸钡沉淀,且硫酸钡与胃酸不反应.
解答:
解:A.硝酸银中含有银离子,银离子有毒,故A错误;
B.硫酸铜中含有铜离子,铜离子有毒,故B错误;
C.碳酸钠能与氯化钡反应生成碳酸钡,但碳酸钡能与胃酸反应生成氯化钡,故不能解毒,故C错误;
D.硫酸镁能与氯化钡反应生成硫酸钡沉淀,且硫酸钡与胃酸不反应,可解毒,故D正确;
故选D.
B.硫酸铜中含有铜离子,铜离子有毒,故B错误;
C.碳酸钠能与氯化钡反应生成碳酸钡,但碳酸钡能与胃酸反应生成氯化钡,故不能解毒,故C错误;
D.硫酸镁能与氯化钡反应生成硫酸钡沉淀,且硫酸钡与胃酸不反应,可解毒,故D正确;
故选D.
点评:本题考查化学与生活,难度不大.要注意掌握重金属离子和“钡餐”的相关知识.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
家用炒菜铁锅用水清洗放置后出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
| A、4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ |
| B、2Fe+2H2O+O2=2Fe(OH)2↓ |
| C、2H2O+O2+4e-=4OH- |
| D、Fe-3e-=Fe3+ |
下列实验操作合理的是( )
| A、用稀硫酸清洗做焰色反应的铂丝 |
| B、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C、用100mL容量瓶配制50mL 0.1 mol?L-1的盐酸 |
| D、测NaOH熔点时可以将NaOH放入石英坩埚中高温熔化 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、标准状况下,22.4LCCl4含有C-Cl键的数目为4NA | ||||
| B、1 L 1 mol?L-1的AlCl3溶液中含有Cl-的数目为3NA | ||||
| C、常温常压下,44 g 由N2O与CO2组成的混合气体含有的氧原子数目为NA | ||||
D、反应NH4N3
|
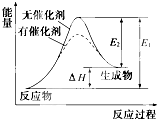 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能改变该反应的焓变 |
| B、催化剂能降低该反应的活化能 |
| C、该反应为放热反应 |
| D、逆反应的活化能大于正反应的活化能 |
关于元素周期表的说法不正确的是( )
| A、元素周期表有7个主族 |
| B、ⅠA族的元素全部是金属元素 |
| C、元素周期表有7个周期 |
| D、短周期是指第一、二、三周期 |
常温下,在下列溶液中一定能大量共存的离子组是( )
| A、酸性溶液:Na+、Fe2+、AlO2-、SO42- |
| B、滴加石蕊试剂呈红色的溶液:Na+、Al3+、SO42-、Cl- |
| C、无色透明溶液:MnO4-、SO42-、K+、NO3- |
| D、强碱性的溶液:CO32-、NH4+、Cl-、Ca2+ |