题目内容
7.反应 Fe+2HCl═FeCl2+H2↑中,还原剂是( )| A. | Fe | B. | HCl | C. | FeCl2 | D. | H2 |
分析 Fe+2HCl═FeCl2+H2↑中,Fe元素的化合价升高,H元素的化合价降低,以此来解答.
解答 解:Fe+2HCl═FeCl2+H2↑中,Fe元素的化合价升高,则为还原剂,
故选B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
18.乙醇、甘油和苯酚的共同点是( )
| A. | 分子结构中都含有羟基,都能与Na反应,产生H2 | |
| B. | 常温下都是无色液体 | |
| C. | 与FeCl3溶液反应呈紫色 | |
| D. | 都能与NaOH溶液发生中和反应 |
2.能源、环境与人类生活密切相关,研究它们的综合利用有重要意义.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示
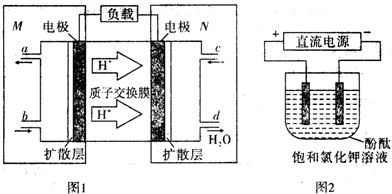
①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
①10min后,甲中达到平衡,则甲中反应的平均速率v(NO2)=0.006mol/(L•min).
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
Ⅰ.二甲醚可代替汽油作新型清洁燃料.常温常压下,二氧化碳加氢可选择性生产二甲醚(CH3OCH3)或一氧化碳.已知二甲醚、氢气的燃烧热分别为-1455kJ/mol,-285.8kJ/mol
(1)写出CO2加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(l)△H=-259.8kJ•mol-1,该反应的平衡常数的表达式为)
$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$..
(2)等物质的量的CO和H2在一定条件下可合成CH3OCH3,同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为:3CO+3H2═CH3OCH3+CO2.
(3)二甲醚燃料电池原理如图1所示

①M区发生的电极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+.
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗CH3OCH3的质量为0.24g(假设溶液电解前后体积不变,保留2位有效数字).
Ⅱ.硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1
(1)下列说法中可以说明该反应已达到平衡状态的是bd
a.体系内混合气体的密度保持不变 h.v(NO2)正=v(SO3)逆
c.容器内气体的总压强保持不变 d.NO体积分数不再改变
(2)某温度下,NO2(g)+SO2(g)?SO3(g)+NO(g)的平衡常数K=$\frac{9}{4}$,该温度下在甲、乙、丙三个体积为2L的恒容密闭容器中,投入NO2(g)和SO2(g),其起始浓度如表所示,
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
②丙达到平衡所用的时间<10min(填“<”“>”“=”),达到平衡后,设甲、乙、丙中SO2(g)的转化率分别为a、b、c,则三者的大小关系为a=c<b.
19.在酸性溶液中,下列各组离子可能共存的是( )
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、NO3-、HCO3- | ||
| C. | SO42-、Fe3+、K+、Cl- | D. | NO3-、K+、SO32-、Mg2+ |
20.下列离子方程式错误的是( )
| A. | 向含有3mol的FeI2溶液中通入标准状况下89.6L 氯气:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| B. | 向铜片中滴加18.4mol/L的浓硫酸并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 向氯化银浊液中加入Na2S溶液:2AgCl+S2-═Ag2S+2Cl- | |
| D. | 向NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- |


 的名称对氟苯甲醛.
的名称对氟苯甲醛.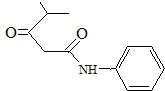 .
.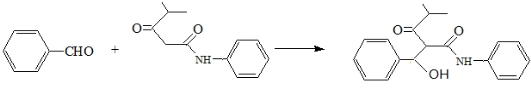 .
.
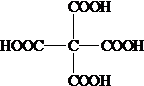 .
.