题目内容
1.所含分子数最少的物质是( )| A. | 0.8molCO2 | B. | 标准状况下11.2L氨气 | ||
| C. | 3.6g水 | D. | 6.02×1023个水分子 |
分析 结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$、n=$\frac{N}{{N}_{A}}$可知,物质的量越小,分子个数越少,以此来解答.
解答 解:A.CO2的物质的量为0.8mol;
B.氨气的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol;
C.水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol;
D.水的物质的量为$\frac{6.02×1{0}^{23}}{{N}_{A}}$≈1mol,
显然C中物质的量最小,则分子数最少,
故选C.
点评 本题考查物质的量的计算,为高频考点,把握微粒数与物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
7.用浓硫酸吸收SO3可得到H2SO4•SO3,若用1.00g98%的硫酸溶液充分吸收SO3后,再进行稀释,可得到98%的硫酸质量为( )
| A. | 1.98g | B. | 2.00g | C. | 2.22g | D. | 2.42g |
12. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z 的单质,q是元素X的单质,s是元素Y的单质且常温下为淡黄色固体,m与r相遇会产生白烟.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 单质沸点:W>X>Z | |
| B. | 原子半径:Y>Z>W | |
| C. | Y的氧化物对应的水化物酸性一定比Z的弱 | |
| D. | W、X、Z三种元素组成的化合物一定是共价化合物 |
9.现有FeO、Fe2O3、Fe3O4组成的混合物mg,向其中加入l00mL2mol/L硫酸,恰好完全溶解,若mg该混合物在过量CO气流中加热充分反应,则冷却后剩余固体的质量为( )
| A. | (m-1.6)g | B. | (m-2.4)g | C. | (m-3.2)g | D. | 无法计算 |
16.如图所示的实验作,能达到相应目的是( )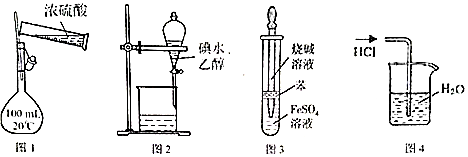

| A. | 用图1装置配制100 mL 0.1mol•L-1硫酸 | |
| B. | 用图2所示装置可萃取碘水中的碘 | |
| C. | 用图3所示装置可制备氢氧化亚铁 | |
| D. | 用图4所示装置可吸收HCl气体 |
6.合理利用燃料,减小污染符合“绿色化学”理念,下列关于燃料的说法正确的是( )
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 通入大大过量的空气使燃料充分燃烧,从而达到充分利用热能的目的 | |
| C. | 燃料的化学能可以在不同的条件下转化为热能、电能被人类利用 | |
| D. | 甲烷是比较洁净的燃料,标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程 式可表示为 CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
13.下列仪器称为“干燥管”的是( )
| A. |  | B. |  | C. |  | D. |  |
10.在无色强酸性溶液中,下列各组离子能大量共存的是( )
| A. | K+、Fe3+、SO42-、NO3- | B. | Na+、K+、NH4+、Cl- | ||
| C. | Ag+、Na+、NO3-、Cl- | D. | K+、Na+、ClO-、CO32- |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.01mol•L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目2NA | |
| C. | 0.1molCu与足量的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA | |
| D. | 2.0g D2O中含有的质子数、电子数均为NA |