题目内容
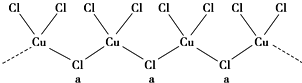
 可以由下列反应合成三聚氰胺:CaO+3C
可以由下列反应合成三聚氰胺:CaO+3C
| ||
CaC2+N2
| ||
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
(2)尿素分子中C原子采取
(3)三聚氰胺(
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 (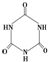 )后,三聚氰酸与三聚氰胺分子相互之间通过
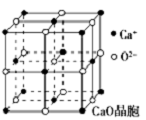
)后,三聚氰酸与三聚氰胺分子相互之间通过(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=
考点:原子核外电子排布,判断简单分子或离子的构型,配合物的成键情况,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理写出该原子的核外电子排布式;根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式;
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;Ca2+采取的堆积方式为面心立方最密堆积,O2-处于Ca2+堆积形成的八面体空隙中;晶格能大小与离子带电量成正比,与离子半径成反比;
(5)铁是26号元素,最外电子层有2个电子,配体提供电子数为12,CN为单齿配体.
(2)根据价层电子对互斥理论确定尿素的VSEPR模型,根据模型确定其杂化方式;
(3)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,从而确定钙离子配位数;Ca2+采取的堆积方式为面心立方最密堆积,O2-处于Ca2+堆积形成的八面体空隙中;晶格能大小与离子带电量成正比,与离子半径成反比;
(5)铁是26号元素,最外电子层有2个电子,配体提供电子数为12,CN为单齿配体.
解答:
解:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线形;
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化.
故答案为:sp2;
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.
故答案为:分子间氢键;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6,Ca2+采取的堆积方式为面心立方最密堆积,O2-处于Ca2+堆积形成的八面体,空隙中;晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,
故答案为:6;面心立方最密堆积;八面体;CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量;
(5)配位化合物K3[Fe(CN)n],铁原子的最外层电子数和配体提供电子数之和为14,铁是26号元素,最外电子层有2个电子,配体提供电子总数为12,CN为单齿配体,得到n=
=6,
故答案为:6.
故答案为:1s22s22p63s23p63d104s2或[Ar]3d104s2;CO2;直线形;
(2)CO(NH2)2分子中中心原子C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化.
故答案为:sp2;
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.
故答案为:分子间氢键;
(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6,Ca2+采取的堆积方式为面心立方最密堆积,O2-处于Ca2+堆积形成的八面体,空隙中;晶格能大小与离子带电量成正比,CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能,
故答案为:6;面心立方最密堆积;八面体;CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量;
(5)配位化合物K3[Fe(CN)n],铁原子的最外层电子数和配体提供电子数之和为14,铁是26号元素,最外电子层有2个电子,配体提供电子总数为12,CN为单齿配体,得到n=
| 12 |
| 2 |
故答案为:6.
点评:本题考查了物质结构知识,涉及核外电子排布、分子空间构型、杂化原理、配合物的计算等,难度一般,易错点是配位数的确定,以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
某微粒用符号ZAMn+表示,下列关于该微粒的叙述正确的是( )
| A、所含质子数为(A-n) |
| B、所含中子数为(A-Z+n) |
| C、所含电子数为(Z-n) |
| D、中子数-电子数=A-2Z-n |
关于化学知识在生活中的应用,下列说法不正确的是( )
| A、开放太阳能可以有效地减少“温室效应”的气体产生 |
| B、医用酒精的浓度越大,杀菌能力越强 |
| C、用灼烧的方法可以鉴别毛织物和棉织物 |
| D、苯酚能用于杀菌、消毒 |
下列物质中可以用来检验酒精中是否含有水的是( )
| A、生石灰 | B、石灰石 |
| C、无水硫酸铜 | D、无水氯化钙 |
下列四组溶液中每组都有三种,其中可用稀H2SO4进行鉴别的一组是( )
| A、BaCl2溶液、Ba(NO3)2溶液、NaCl溶液 |
| B、Na2CO3溶液、BaCl2溶液、MgCl2溶液 |
| C、Ba(NO3)2溶液、KCl溶液、MgCl2溶液 |
| D、Na2CO3溶液、K2CO3溶液、NaCl溶液 |