题目内容
18.运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.(1)用CO可以合成甲醇.已知:
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
则CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1.
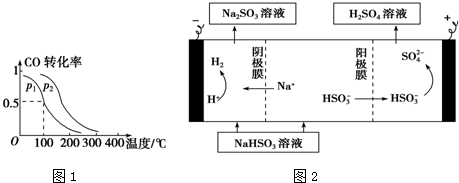
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示.
①p1小于p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=$\frac{V{\;}^{2}}{a{\;}^{2}}$;
(3)某科研小组用SO2为原料制取硫酸.
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池负极的电极反应式:SO2-2e-+2H2O═SO42-+4H+.
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸.电解原理示意图如图2.请写出开始时阳极反应的电极反应式:HSO3-+H2O-2e-=SO42-+3H+.
分析 (1)①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1,
依据盖斯定律②+③×2-①进行计算;
(2)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;
②该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则根据化学平衡常数K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$进行计算;
(3)①依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
②根据化合价变化判断阳极反应物质,写出阳极反应式.
解答 解:(1)①CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-764.5kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1,
依据盖斯定律②+③×2-①得:CO(g)+2H2(g)═CH3OH(g)△H,则△H=△H2+2△H3-△H1=-90.1KJ/mol;
故答案为:-90.1;
(2)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,故答案为:小于;
②该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol,n(CH3OH)=c(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol,则c(CO)=$\frac{0.5a}{V}$mol/L、c(CH3OH)=$\frac{0.5a}{V}$mol/L、c(H2)=$\frac{a}{V}$mol/L,化学平衡常数K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$=$\frac{\frac{0.5a}{V}}{\frac{0.5a}{V}×\frac{a{\;}^{2}}{V{\;}^{2}}}$=$\frac{V{\;}^{2}}{a{\;}^{2}}$,故答案为:$\frac{V{\;}^{2}}{a{\;}^{2}}$;
(3)①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评 本题主要考查了盖斯定律、可逆反应转化率随温度和压强变化的曲线以及原电池原理和电解原理的应用,注意电极反应的书写方法,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
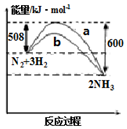
| A. | 该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=92kJ•mol-1 | |
| B. | b曲线是升高温度时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的活化能和反应热都改变 | |
| D. | 在温度体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ,则184>Q2>2Q1 |