题目内容
11.下列操作一定会引起实验偏差的是( )| A. | 用盐酸滴定氢氧化钠溶液时,滴定前,酸式滴定管内无气泡,滴定后也无气泡 | |
| B. | 用盐酸滴定氢氧化钠溶液时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变 | |
| C. | 某学生要配制0.1 mol•L-1的稀硫酸100 mL,当加蒸馏水到离容量瓶刻度线1~2 cm处时,改用胶头滴管滴加,结果不慎使液面稍稍超过刻度线一点,将多余部分吸出,使凹液面最低点与刻度线相切 | |
| D. | 物质的量浓度为0.05 mol•L-1的NaOH标准溶液因与空气接触吸收了少量CO2,用此标准液滴定未知物质的量浓度的HCl溶液 |
分析 A.滴定前,酸式滴定管内无气泡,滴定后也无气泡,标准溶液的体积没有误差;
B.达到滴定终点时,溶液颜色发生突变,并且半分钟内不恢复原来的颜色;
C.配制溶液时加水超过刻度线,溶液的体积偏大;
D.如用甲基橙为指示剂,溶质只有NaCl,对实验没有影响.
解答 解:A.滴定前,酸式滴定管内无气泡,滴定后也无气泡,标准溶液的体积没有误差,所以操作不会引起实验偏差,故A不选;
B.用盐酸滴定氢氧化钠溶液时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变,说明恰好达到滴定终点,所以没有产生实验偏差,故B不选;
C.配制溶液时加水超过刻度线,溶液的体积偏大,硫酸的浓度偏小,操作一定会引起实验偏差,故C选;
D.甲基橙变色的PH范围是3.1~4.4,用甲基橙作指示剂滴定后溶液呈酸性,滴定时Na2CO3全部反应生成NaCl,由钠元素守恒可知,NaOH加盐酸生成NaCl,对实验没有影响,故D不选.
故选C.
点评 本题考查实验方案的评价,侧重学生的分析、实验能力的考查,主要把握溶液配制、酸碱中和滴定的实验原理和操作方法,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | Cu(NO3)2 |
6.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | 物质WY2、W3X4、WZ4均有熔点高、硬度小的特性 |
20.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 检测时,电解质溶液中的H+向负极移动 | |
| B. | 若有0.2mol电子转移,则消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应是:O2+4e-+2H2O═4OH- |
1.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2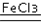 2H2O+O2↑.
2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率 (用实验中提供的试剂).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
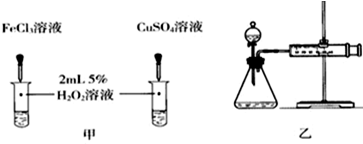
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴等浓度 FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
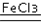 2H2O+O2↑.
2H2O+O2↑.(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率 (用实验中提供的试剂).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是控制阴离子相同,排除阴离子的干扰.
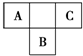 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
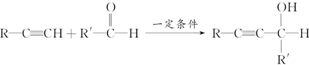
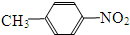 和
和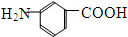 E、35Cl和37Cl
E、35Cl和37Cl