题目内容
5.2015年5月5日,北京开启“烧烤”模式,气温高达 35℃,臭氧代替 PM2.5 坐上大气 污染物的“头把交椅”.汽车和工业废气中的氮氧化物因经光化学反应可形成臭氧而被列入北京的污染物排放源清单.氮氧化物处理通常有下列途径:(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质
①反应 2NO(g)+2CO(g)?2CO2(g)+N2(g)能够自发进行,则该反应的△H<0(填“>”或“<”).
②根据传感器记录某温度下 NO、CO 的反应进程,测量所得数据绘制出图 1.前1S内平均反应速率v(N2)=2.7×10-4mol/(L.s);第 2S时的X值范围25.2<X<30.6.
③在一定温度下,向体积为VL的密闭容器中充入一定量的NO和CO.在t1时刻达到平衡
状态,此时 n(CO)=amol,n(NO)=2amol,n(N2)=bmol.若保持体积不变,再向容器中充 入 n(CO2)=bmol,n(NO)=amol,则此时 v 正=v逆(填“>”、“=”或“<”);
④在t2时刻,将容器迅速压缩到原容积的$\frac{1}{2}$,在其它条件不变的情况下,t3时刻达到新的平衡状态.请在图2中补充画出t2-t3-t4时段N2物质的量的变化曲线.
(2)烟气中含有的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染.
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)K1△H=a kJ•mol-1;N2(g)+O2(g)═2NO(g)K2△H=b kJ•mol-1;
CH4脱硝的热化学方程式为 CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a-2b)kJ•mol-1; 平衡常数K=$\frac{{K}_{1}}{{{K}_{2}}^{2}}$(K用 K1、K2表示)
(3)C2H4也可用于烟气脱硝.为研究温度、催化剂中 Cu2+负载量对其NO去除率的影响,控制其他条件一定实验结果如图3所示.为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是350℃、负载率3%.
(4)工业尾气中氮的氧化物常采用碱液吸收法处理.NO2被足量纯碱溶液完全吸收后得到两种钠盐,同时产生CO2.请写出NO2与纯碱反应的化学方程式:Na2CO3+2NO2═NaNO3+NaNO2+CO2.

分析 (1)①反应自发进行的判断依据为△H-T△S<0;
②利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(CO2);根据速率之比等于化学计量数之比求v(N2);根据随着反应进行反应速率越来越小分析;
③根据三行式结合化学平衡的移动知识来计算分析;
④压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,据此画出从t2-t3-t4时段,正反应速率的变化曲线;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,依据反应的平衡常数计算分析平衡常数的关系;
(3)脱硝率高,负载率低,适宜的温度;
(4)反应与NO2和NaOH反应相似,生成NaNO2、NaNO3和CO2,以此书写反应的化学方程式.
解答 解:(1)①反应 2NO(g)+2CO(g)?2CO2(g)+N2(g)能够自发进行,反应△S<0,若满足△H-T△S<0,必须△H<0,
故答案为:<;
②一氧化氮的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×1{0}^{-4}mol/L}{1s}$=5.4×10-3mol/L.s,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,
同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,
故答案为:2.7×10-4mol/(L.s);25.2<X<30.6;
③在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO.在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol.依据化学平衡三段式列式计算
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 2a+2b a+2b 0 0
变化量(mol) 2b 2b b 2b
平衡量(mol) 2a a b 2b
若保持体积不变,再向容器中充入n(CO2)=b mol,n(NO)=a mol,正逆进行程度相同,平衡不动,正逆反应速率相同;
故答案为:=;
④在t2时刻,将容器迅速压缩到原容积的$\frac{1}{2}$,在其它条件不变的情况下,瞬间氮气物质的量不变,浓度增大,相当于增大压强,平衡正向进行,氮气物质的量增大,最后不变,t3时刻达到新的平衡状态如图 ;
;
故答案为: ;
;
(2)①CH4(g)+2O2(g)═CO2(g)+2H2O(l) K1=$\frac{c(C{O}_{2}){c}^{2}({H}_{2}O)}{c(C{H}_{4}){c}^{2}({O}_{2})}$△H=a kJ•mol-1;
②N2(g)+O2(g)═2NO(g) K2=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$ △H=b kJ•mol-1;
依据盖斯定律计算,①-②×2得到CH4脱硝的热化学方程式为 CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a-2b )kJ•mol-1;
K3=$\frac{c(C{O}_{2}){c}^{2}({N}_{2}){c}^{2}({H}_{2}O)}{c(C{H}_{4}){c}^{4}(NO)}$=$\frac{{K}_{1}}{{{K}_{2}}^{2}}$,
故答案为:(a-2b )kJ•mol-1;K3=$\frac{{K}_{1}}{{{K}_{2}}^{2}}$;
(3)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃、负载率3%.
故答案为:350℃、负载率3%;
(4)反应与NO2和NaOH反应相似,生成NaNO2、NaNO3和CO2,则反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2,
故答案为:2NO2+Na2CO3=NaNO2+NaNO3+CO2.
点评 本题考查盖斯定律的应用、放热反应与吸热反应、热化学方程式的书写.难度中等.根据图象分析出分解率的变化特点是解题的关键,掌握基础是关键.

| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•s-1.
(3)在该温度下,反应的平衡常数K=5000.
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是C、D.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
| A. | △H>0,△S>0 的反应任何条件都是非自发反应 | |
| B. | 放热反应均能自发进行,且反应放出的热量越多,反应越完全 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 水从固态→液态→气态的变化过程中△S>0 |
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | Na2O熔融状态下能导电,所以Na2O是电解质 | |
| D. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 |
①

②
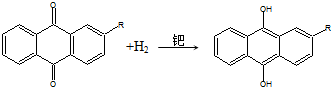
下列说法不正确的是( )
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY- 离子水解的离子方程式:HY-+H2O?H2Y+OH- | |
| C. | 该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
| A. | NaHSO4 | B. | Al2O3 | C. | NaHCO3 | D. | Al(OH)3 |