题目内容
13.下列说法正确的是( )| A. | △H>0,△S>0 的反应任何条件都是非自发反应 | |
| B. | 放热反应均能自发进行,且反应放出的热量越多,反应越完全 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 水从固态→液态→气态的变化过程中△S>0 |
分析 A、根据自发进行的条件是△H-T△S<0分析判断;
B、反应自发与否决定于焓变和熵变两个因素;
C、根据自发进行的条件是△H-T△S<0分析判断;
D、固态→液态→气态,混乱度增大.
解答 解:A、自发进行的条件是△H-T△S<0分析判断,△H>0,△S>0,高温下反应可以自发进行,故A错误;
B、放热的熵减小的反应高温下不能自发进行,故B错误;
C、△H>0、△S<0的反应,△H-T•△S>0,该反应一定不能自发进行,但在一定条件下可以正向进行,如:电解饱和食盐水,在通电的条件下可以正向进行,但是不能自发进行,故C错误;
D、水由固态→液态→气态,混乱度增大,△S>0,故D正确;
故选D.
点评 本题考查反应热与焓变,难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,不能把其中一个因素当做判断反应能自发进行的依据,学习中注意该部分知识的积累.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
1.下列方程式中,属于水解反应的是( )
| A. | CO+H2O?CO2+H2 | B. | H2PO4-+H2O?HPO42-+H3O+ | ||
| C. | Cl-+H2O?HCl+OH- | D. | HS-+H2O?H2S+OH- |
8.下列反应的离子方程式正确的是( )
| A. | H2S通入CuSO4溶液中 S2-+Cu2+=CuS↓ | |
| B. | AgCl投入KI溶液中 Ag++I-=AgI↓ | |
| C. | Na2S的水解反应 S2-+2H2O?H2S+2OH- | |
| D. | NH4NO3溶液呈酸性 NH4++H2O?NH3•H2O+H+ |
18.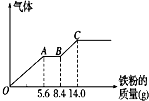 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
 向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )
向 100mL 某稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的量(相同状况)随铁粉 质量增加的变化如图所示(已知硝酸只被还原为 NO 气体).下列分析或结果错误的是( )| A. | OA 段产生的是 NO,BC 段产生氢气,溶液中最终溶质为 FeSO4 | |
| B. | AB 段的反应为 Fe+2Fe3+═3Fe2+, | |
| C. | 原混合酸中NO3-物质的量为 0.3mol | |
| D. | H2SO4 浓度为 2.5 mol•L-1 |
2.某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
3.在Zn+HNO3→Zn(NO3)2+NH4NO3+H2O的反应中,如果2mol Zn完全起反应,则被还原的HNO3的物质的量是( )
| A. | 0.5mol | B. | 1mol | C. | 2mol | D. | 5mol |

