题目内容
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| D、标准状况下,11.2LH2O含有的分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n=
=
计算;
B、依据气体摩尔体积的条件应用分析判断;
C、依据n=
计算物质的量,结合分子式计算原子数;
D、标准状况水不是气体.
| N |
| NA |
| V |
| 22.4 |
B、依据气体摩尔体积的条件应用分析判断;
C、依据n=
| m |
| M |
D、标准状况水不是气体.
解答:
解:A、依据n=
=
计算,含有NA个氦原子的氦气物质的量为1mol,氦气是单原子分子,在标准状况下的体积约为22.4L,故A错误;
B、在常温常压下,11.2L Cl2物质的量不是0.5mol,故B错误;
C、由n=
可知,物质的量=
=1mol,则原子数3NA,故C正确;
D、标准状况水不是气体,11.2LH2O物质的量不是0.5mol,故D错误;
故选C.
| N |
| NA |
| V |
| 22.4 |
B、在常温常压下,11.2L Cl2物质的量不是0.5mol,故B错误;
C、由n=
| m |
| M |
| 64g |
| 64g/mol |
D、标准状况水不是气体,11.2LH2O物质的量不是0.5mol,故D错误;
故选C.
点评:本题考查了气体摩尔体积的分析判断,掌握基础是关键,注意氦气是单原子分子,题目较简单.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A、有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-═Al3+ |
| B、Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-═Al3+ |
| C、由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-═Fe2+ |
| D、由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-═Cu2+ |
下列有关物质的性质和应用的说法均正确的是( )
| A、二氧化硅能与NaOH溶液反应,不能用玻璃瓶盛放NaOH溶液 |
| B、Cl2能与Ca(OH)2反应,可以用澄清石灰水吸收尾气中的Cl2 |
| C、BaCO3、BaSO4都难溶于水,均可用做钡餐 |
| D、Al与Fe2O3能发生铝热反应,可用于焊接钢轨 |
下列说法中正确的是( )
| A、NH4NO3溶于水吸热,说明其溶于水不是自发过程 |
| B、反应C(s)+CO2(g)═2CO(g)为熵增加的反应,常温下一定自发进行 |
| C、熵增加且放热的反应一定是自发反应 |
| D、非自发反应在任何条件下都不能实现 |
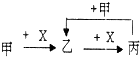 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )| A、甲:Na、X:O2 |
| B、甲:NaOH溶液、X:CO2溶液 |
| C、甲:C、X:O2 |
| D、甲:AlCl3溶液、X:NaOH溶液 |
下列说法正确的是( )
| A、冰、水和水蒸气中都存在氢键 |
| B、除稀有气体外的非金属元素都能生成不同价态的含氧酸 |
| C、若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11 |
| D、干冰升华时分子内共价键会发生断裂 |
A、B、C、D为短周期主族元素,且原子序数依次增大.已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A、非金属性:A>B |
| B、原子半径:C>D>A>B |
| C、元素B和C只能形成一种化合物 |
| D、A、C、D的最高价氧化物对应的水化物均能相互反应 |
下列化学用语使用正确的是( )
A、甲烷分子的球棍模型: | ||
B、氢氧根离子的电子式: | ||
C、氯原子的结构示意图: | ||
D、中子数为146、质子数为92的铀(U)原子
|