题目内容
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图1:
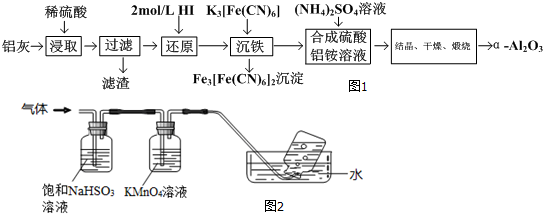
(1)Fe3[Fe(CN)6]2沉淀的颜色 .
(2)图1中“滤渣”主要成分在高温条件下与碳单质的反应方程式为 .
(3)加2mol/LHI溶液发生的离子反应方程式为 .
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2?12H2O]
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过图2所示的装置.
①根据上述方程式,每产生1molAl2O3转移的电子数为 .
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式).
③KMnO4溶液颜色变浅,发生的离子反应方程式为 .

(1)Fe3[Fe(CN)6]2沉淀的颜色
(2)图1中“滤渣”主要成分在高温条件下与碳单质的反应方程式为
(3)加2mol/LHI溶液发生的离子反应方程式为
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2?12H2O]
| ||
①根据上述方程式,每产生1molAl2O3转移的电子数为
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有
③KMnO4溶液颜色变浅,发生的离子反应方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)Fe3[Fe(CN)6]2依据为特征蓝色或蓝色;
(2)Al2O3、FeO、Fe2O3均能够与稀硫酸反应生成易溶性硫酸盐,二氧化硅与硫酸不反应,判断滤渣为二氧化硅,结合二氧化硅性质解答;
(3)滤液中含有硫酸铁,能够氧化碘离子;
(4)①[NH4Al(SO4)2?12H2O]中氮元素变成氮气,化合价升高3价,S变成SO2,化合价降低2价据此解答;
②依据反应生成的气体的成分及性质解答;
③反应生成的混合气体,通过饱和NaHSO3溶液吸收后剩余二氧化硫,具有强的还原性能够被酸性的高锰酸钾氧化.
(2)Al2O3、FeO、Fe2O3均能够与稀硫酸反应生成易溶性硫酸盐,二氧化硅与硫酸不反应,判断滤渣为二氧化硅,结合二氧化硅性质解答;
(3)滤液中含有硫酸铁,能够氧化碘离子;
(4)①[NH4Al(SO4)2?12H2O]中氮元素变成氮气,化合价升高3价,S变成SO2,化合价降低2价据此解答;
②依据反应生成的气体的成分及性质解答;
③反应生成的混合气体,通过饱和NaHSO3溶液吸收后剩余二氧化硫,具有强的还原性能够被酸性的高锰酸钾氧化.
解答:
解:(1)Fe3[Fe(CN)6]2的颜色为:特征蓝色或蓝色,故答案为:特征蓝色或蓝色;
(2)铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加入稀硫酸后,Al2O3、FeO、Fe2O3均能够与稀硫酸反应生成易溶性硫酸盐,剩余滤渣为二氧化硅,高温下,二氧化硅与碳反应生成硅和一氧化碳,方程式为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑;
(3)滤液中含有硫酸铁,能够氧化碘离子,反应的离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)①依据方程式:4[NH4Al(SO4)2?12H2O]
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,氮元素变成氮气,化合价升高3价,S变成SO2,化合价降低2价,每产生2molAl2O3转移6mol电子,所以每产生1molAl2O3转移的电子数为3mol,个数为3NA,故答案为:3NA;
②煅烧硫酸铝铵晶体,生成的气体有NH3、N2、SO3、SO2、H2O,氨气、三氧化硫易溶于水,能够被饱和NaHSO3溶液吸收,二氧化硫、氮气不溶于水,不能被吸收;
故答案为:NH3和SO3;
③二氧化硫能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,反应的方程式为:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+;
故答案为:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+.
(2)铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),加入稀硫酸后,Al2O3、FeO、Fe2O3均能够与稀硫酸反应生成易溶性硫酸盐,剩余滤渣为二氧化硅,高温下,二氧化硅与碳反应生成硅和一氧化碳,方程式为:SiO2+2C
| ||
| ||
(3)滤液中含有硫酸铁,能够氧化碘离子,反应的离子方程式为:2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(4)①依据方程式:4[NH4Al(SO4)2?12H2O]
| ||
②煅烧硫酸铝铵晶体,生成的气体有NH3、N2、SO3、SO2、H2O,氨气、三氧化硫易溶于水,能够被饱和NaHSO3溶液吸收,二氧化硫、氮气不溶于水,不能被吸收;
故答案为:NH3和SO3;
③二氧化硫能够与酸性高锰酸钾发生氧化还原反应,使高锰酸钾褪色,反应的方程式为:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+;
故答案为:5SO2+2H2O+2MnO4-=2Mn2++5SO42-+4H+.
点评:本题考查了物质分离和提纯,明确物质的性质是解题关键,注意氧化还原方程式的电子转移分析方法,为高考热门考点.

练习册系列答案
相关题目
下列实验操作过程能引起结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗.
②用量筒量取5.0mL溶液时,俯视读数.
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线.
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数.
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗.
②用量筒量取5.0mL溶液时,俯视读数.
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线.
④用已知浓度的盐酸滴定未知浓度的NaOH溶液时,滴定前平视读数,滴定终点仰视读数.
| A、③④ | B、②③ | C、①④ | D、①② |
下列有关化学实验的叙述正确的是( )
| A、用待测液润洗滴定用的锥形瓶 |
| B、配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| C、用稀硝酸酸洗涤盛做过银镜反应的试管 |
| D、液溴保存时液面覆盖一层水,装在带橡胶塞的试剂瓶中 |
下列装置或操作能达到实验目的是( )
A、 检查装置气密性 |
B、 从碘的CCl4溶液中分离出碘 |
C、 除去甲烷中乙烯 |
D、 分离甲苯与乙醇 |
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图: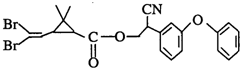 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )
 则下列对该化合物叙述正确的是( )
则下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、属于卤代烃 |
| C、在酸性和碱性条件下都不能水解 |
| D、在一定条件下可以发生加成反应 |
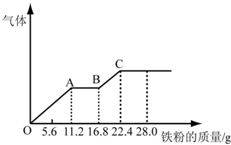 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.