题目内容
 等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )
等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,生成H2的质量与反应时间关系如图所示.下列叙述中不正确 的是( )| A、失去的电子数:M>N |
| B、生成H2的反应速率:M>N |
| C、消耗HCl的物质的量:M>N |
| D、a、b两点时所消耗金属的质量:M>N |
考点:化学方程式的有关计算
专题:
分析:A.生成的氢气越多,失电子数越多;
B.所用时间越短,反应速率越快;
C.生成的氢气越多,消耗的HCl越多;
D.金属的质量相同时,M生成的氢气多,生成相同氢气时,消耗M少.
B.所用时间越短,反应速率越快;
C.生成的氢气越多,消耗的HCl越多;
D.金属的质量相同时,M生成的氢气多,生成相同氢气时,消耗M少.
解答:
解:A.生成的氢气越多,失电子数越多,由图可知等质量的两种活泼金属M和N,分别与足量的盐酸充分反应,M生成的氢气多,则失去的电子数:M>N,故A正确;
B.所用时间越短,反应速率越快,则生成H2的反应速率:M>N,故B正确;
C.生成的氢气越多,消耗的HCl越多,已知M生成的氢气多,则消耗HCl的物质的量:M>N,故C正确;
D.金属的质量相同时,M生成的氢气多,生成相同氢气时,消耗M少,所以a、b两点时所消耗金属的质量:M<N,故D错误.
故选D.
B.所用时间越短,反应速率越快,则生成H2的反应速率:M>N,故B正确;
C.生成的氢气越多,消耗的HCl越多,已知M生成的氢气多,则消耗HCl的物质的量:M>N,故C正确;
D.金属的质量相同时,M生成的氢气多,生成相同氢气时,消耗M少,所以a、b两点时所消耗金属的质量:M<N,故D错误.
故选D.
点评:本题主要以图象的形式考查了金属与酸反应生成氢气的量的关系,题目难度不大,注意把握生成氢气多少与金属失电子数的关系,侧重于基础知识应用的考查.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
根据下表中有关短周期元素性质的数据,判断下列说法不正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.73 | 1.30 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 0.90 | |
| 主 要 化 合 价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +2 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A、③和⑥、④和⑦分别处于同一主族 |
| B、元素④处于第三周期ⅤA族 |
| C、元素⑧对应的氢氧化物可能具有两性 |
| D、元素①与元素⑥形成的化合物中不可能存在共价键 |
下列为人体提供能量的营养物质中,属于高分子化合物的是( )
| A、蛋白质 | B、油脂 |
| C、葡萄糖 | D、蔗糖 |
下列说法正的是( )
| A、1 mol 蔗糖可水解生成2 mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
| C、C4H9Cl共有同分异构体9种 |
D、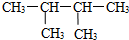 的名称是2,3-二甲基丁烷 的名称是2,3-二甲基丁烷 |
资源利用、环境保护等在与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A、改进汽车尾气净化技术,减少大气污染物的排放 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、开发利用新能源,减少化石燃料的使用 |
| D、加强对工业“三废”的治理,保护环境 |
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末.该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”.同学们对此有下列一些理解,其中错误的是( )
| A、反应中物质的化合价没有发生变化 |
| B、制造过程中元素种类没有改变 |
| C、CCl4是一种化合物 |
| D、这个反应是氧化还原反应 |