题目内容
海洋是一个巨大的化学资源宝库,下图是海水加工的示意图:
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种).
(2)下图是从浓缩海水中提取溴的流程图.写出下图中试剂A的化学式 ,Na2CO3溶液中发生反应的化学方程式为 .

(3)制备金属镁是通过电解熔融的MgCl2,而不用MgO,其原因是 .
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2.海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 .电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 .

(1)海水淡化工厂通常采用的制备淡水的方法有
(2)下图是从浓缩海水中提取溴的流程图.写出下图中试剂A的化学式

(3)制备金属镁是通过电解熔融的MgCl2,而不用MgO,其原因是
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2.海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是
考点:海水资源及其综合利用,氯、溴、碘及其化合物的综合应用
专题:卤族元素
分析:(1)目前淡化海水的方法有多种,常用方法有蒸馏、电渗析以及离子交换法等,以此解答.
(2)从浓缩海水中提取溴,先进行溴离子的富集得到溴离子,最后再次用氯气氧化;
可以看成是溴气溶于水,生成HBr和HBrO,然后再与氢氧化钠反应;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高;
(4)食盐水中含有杂质离子Mg2+、Ca2+,一定条件下生成沉淀损害离子交换膜;根据电解食盐水的产物之间能反应.
(2)从浓缩海水中提取溴,先进行溴离子的富集得到溴离子,最后再次用氯气氧化;
可以看成是溴气溶于水,生成HBr和HBrO,然后再与氢氧化钠反应;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高;
(4)食盐水中含有杂质离子Mg2+、Ca2+,一定条件下生成沉淀损害离子交换膜;根据电解食盐水的产物之间能反应.
解答:
解:(1)目前淡化海水的方法有多种,海水淡化工厂通常采用的制备淡水的方法有蒸馏法、电渗析法;
故答案为:蒸馏法、电渗析法;
(2)从浓缩海水中提取溴,先进行溴离子的富集得到溴离子,最后再次用氯气氧化;
溴气溶于水,生成HBr和HBrO,然后HBr和HBrO分别与Na2CO3反应,所以溴气与Na2CO3反应的化学方程式:Br2+Na2CO3=NaBr+CO2+NaBrO;
故答案为:Cl2;Br2+Na2CO3=NaBr+CO2+NaBrO;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁;
故答案为:MgO的熔点为2800℃、熔点高,电解时耗能高;
(4)用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜,所以要用阳离子交换塔除去Mg2+、Ca2+;电解食盐水的产物有氯气、氢气和氢氧化钠,氯气与氢氧化钠能反应,氢气与氯气也能反应,所以电解食盐水在离子交换膜电解槽中进行;
故答案为:用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与C12混合发生爆炸,同时防止C1-进入阴极室,这样可以获得纯净的NaOH.
故答案为:蒸馏法、电渗析法;
(2)从浓缩海水中提取溴,先进行溴离子的富集得到溴离子,最后再次用氯气氧化;
溴气溶于水,生成HBr和HBrO,然后HBr和HBrO分别与Na2CO3反应,所以溴气与Na2CO3反应的化学方程式:Br2+Na2CO3=NaBr+CO2+NaBrO;
故答案为:Cl2;Br2+Na2CO3=NaBr+CO2+NaBrO;
(3)MgO的熔点为2852℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁;
故答案为:MgO的熔点为2800℃、熔点高,电解时耗能高;
(4)用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜,所以要用阳离子交换塔除去Mg2+、Ca2+;电解食盐水的产物有氯气、氢气和氢氧化钠,氯气与氢氧化钠能反应,氢气与氯气也能反应,所以电解食盐水在离子交换膜电解槽中进行;
故答案为:用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜;防止H2与C12混合发生爆炸,同时防止C1-进入阴极室,这样可以获得纯净的NaOH.
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组物质中,互为同素异形体的是( )
| A、13C 和14C |
| B、红磷和白磷 |
| C、氯水和液氯 |
| D、重水和超重水 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、30g甲醛(HCHO)和醋酸的混合物中含碳原子数目为NA |
| B、1mol Cl2与足量的NaOH溶液反应,转移的电子数为2NA |
| C、100mL 0.2mol?L-1的AlCl3溶液中,含Al3+数为0.02NA |
| D、标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |


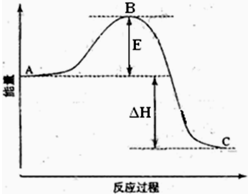 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: