题目内容
19.化学与人类生产、生活环境密切相关.下列说法正确的是( )| A. | 化石燃料的大量开发和使用是导致温室效应和形成酸雨的重要原因 | |
| B. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| C. | 为了确保食品安全,应禁止使用食品添加剂 | |
| D. | 为了提高农作物产量,应该大量使用农药和化肥 |
分析 A.化石燃料燃烧会生成二氧化碳和二氧化硫;
B.加点盐中加的是碘酸钾;
C.科学合理的使用食品添加剂,可以改变食品的品质;
D.大量使用农药和化肥会造成环境污染.
解答 解:A.化石燃料燃烧会生成二氧化碳和二氧化硫,二氧化碳会引起温室效应,二氧化硫会形成酸雨,故A正确;
B.为消除碘缺乏病,政府规定在食盐中必须添加一定量的碘酸钾,KI易被氧化,故B错误;
C.科学合理的使用食品添加剂,可以改变食品的品质,所以可以适当的使用食品添加剂,故C错误;
D.大量使用农药和化肥会造成环境污染,所以应该尽量减少农药和化肥,故D错误.
故选A.
点评 本题考查了环境保护、食品添加剂,题目难道不大,侧重于考查化学知识在生产生活中的应用,注意把握相关基础知识.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
9.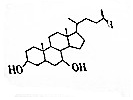 鹅去氧胆酸是目前世界上用量最大的治胆结石药物之一,其结构简式如图所示,下列关于鹅去氧胆酸的说法正确的是( )
鹅去氧胆酸是目前世界上用量最大的治胆结石药物之一,其结构简式如图所示,下列关于鹅去氧胆酸的说法正确的是( )
 鹅去氧胆酸是目前世界上用量最大的治胆结石药物之一,其结构简式如图所示,下列关于鹅去氧胆酸的说法正确的是( )
鹅去氧胆酸是目前世界上用量最大的治胆结石药物之一,其结构简式如图所示,下列关于鹅去氧胆酸的说法正确的是( )| A. | 分子中含有4个苯环 | |
| B. | 1mol鹅去氧胆酸和足量NaHCO3溶液反应产生3molCO2 | |
| C. | 不能使酸性KMnO4溶液褪色 | |
| D. | 能发生取代、氧化等反应 |
10.下列实验操作和理象、结论均正确且有因果关系的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中滴加CCl4,振荡、静置,下层溶液显紫色 | 原溶液中含有I- |
| B | 常温下,0.1mol/LNaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| C | 相同温度下,测得饱和亚硫酸溶液的pH小于饱和碳酸溶液的pH | 亚硫酸的酸性强于碳酸 |
| D | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入KSCN溶液不显红色 | 稀HNO3将Fe氧化为Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
7.下列化学反应所对应的离子方程式书写正确的是( )
| A. | 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+NH4+ | |
| B. | 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓ | |
| C. | 硫酸铜溶液中加入过量的氢氧化钡:Ba2++SO42-→BaSO4↓ | |
| D. | 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2 |
14.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 稀豆浆、食盐水均可产生丁达尔效应 | |
| B. | 利用生物质能就是间接利用太阳能 | |
| C. | 钢铁在潮湿的空气中主要发生化学腐蚀 | |
| D. | 纯铝质轻,耐腐蚀性强,可直接用作航天材料 |
4.用NA表示阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 含4.9 g H2SO4与4.9 g H3PO4的混合溶液中氧原子数为0.4NA | |
| C. | 常温下,0.1 mol C2H4分子中含共用电子对数目为0.6NA | |
| D. | 25℃时,Ksp(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA |
11.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 100mL12Lmol•L-1浓盐酸与足量MnO2共热,转移的电子数为0.6NA | |
| B. | 1mol•L-1的NaClO溶液中含有ClO-的数目为小于NA | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| D. | O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA |
18.将5gAl、Al2O3、Al(OH)3的混合物与200g4.9%的稀硫酸混合,恰好完全反应.将反应后的溶液蒸干后,最终得到固体的质量是( )
| A. | 11.4g | B. | 14.8g | C. | 205g | D. | 无法计算 |