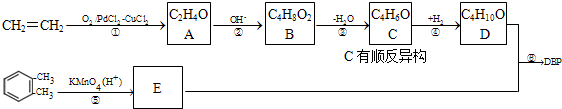
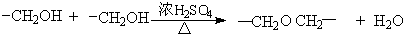题目内容
已知BOH溶液存在平衡:BOH?B++OH-,△H>0,完成下表.
| 改变条件 | 移动方向 | c(OH-) | c(B+) |
| 升高温度 | | | |
| 降低温度 | | | |
| 加入BOH | | | |
| 加入大量H2O | | | |
| 加浓硫酸 | | | |
| 加NaOH | | | |
| 加BCl | | |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:BOH是弱碱,其电离是吸热过程,升温,平衡正向进行,增大B+或OH-浓度时,平衡逆向移动,但水的离子积常数指受温度影响,据此分析.
解答:
解:BOH是弱碱,其电离是吸热过程,升温,平衡正向进行,增大B+或OH-浓度时,平衡逆向移动,但水的离子积常数指受温度影响,
升高温度,平衡正向移动,溶液碱性增强,氢氧根离子浓度增大,c(B+)浓度增大;故答案为:正向移动;增大;增大;
降低温度,平衡逆向移动,溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度减小;故答案为:逆向移动;减小;减小;
加入BOH,增大反应物浓度,平衡正向移动,溶液碱性增强,氢氧根离子浓度增大,c(B+)浓度增大;故答案为:正向移动;增大;增大;
加入大量水,促进弱电解质的电离,平衡正向移动,但溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度减小;故答案为:正向移动;减小;减小;
加入浓硫酸,中和了氢氧根,促进BOH电离,平衡正向移动,溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度增大;故答案为:正向移动;减小;增大;
加NaOH,溶液碱性增强,抑制BOH的电离,平衡逆向移动,但氢氧根离子浓度增大,c(B+)浓度减小;故答案为:逆向移动;增大;减小;
加入BCl,c(B+)增大,抑制BOH电离,平衡逆向移动,氢氧根离子浓度减小,c(B+)浓度增大;故答案为:逆向移动;减小;增大.
升高温度,平衡正向移动,溶液碱性增强,氢氧根离子浓度增大,c(B+)浓度增大;故答案为:正向移动;增大;增大;
降低温度,平衡逆向移动,溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度减小;故答案为:逆向移动;减小;减小;
加入BOH,增大反应物浓度,平衡正向移动,溶液碱性增强,氢氧根离子浓度增大,c(B+)浓度增大;故答案为:正向移动;增大;增大;
加入大量水,促进弱电解质的电离,平衡正向移动,但溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度减小;故答案为:正向移动;减小;减小;
加入浓硫酸,中和了氢氧根,促进BOH电离,平衡正向移动,溶液碱性减弱,氢氧根离子浓度减小,c(B+)浓度增大;故答案为:正向移动;减小;增大;
加NaOH,溶液碱性增强,抑制BOH的电离,平衡逆向移动,但氢氧根离子浓度增大,c(B+)浓度减小;故答案为:逆向移动;增大;减小;
加入BCl,c(B+)增大,抑制BOH电离,平衡逆向移动,氢氧根离子浓度减小,c(B+)浓度增大;故答案为:逆向移动;减小;增大.
点评:本题考查了从浓度变化角度影响平衡移动的因素,注意溶液稀释时平衡正向移动,但各离子浓度减小,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列过程一定不能自发发生的是( )
| A、水从高处流向低处 |
| B、食盐溶解于水中 |
| C、水分解成H2和O2 |
| D、生石灰与水反应生成熟石灰 |
关于分散系,下列叙述中正确的是( )
| A、分散系分为胶体和溶液 |
| B、电泳现象可证明胶体带电荷 |
| C、利用丁达尔效应可以区别溶液与胶体 |
| D、按照分散质和分散剂状态不同(固、液、气),它们之间可有6种组合方式 |