题目内容
19.下列电离方程式书写正确的是( )| A. | H2S?2H++S2- | B. | CH3COOH?H++CH3COO- | ||
| C. | NH3+H2O═NH${\;}_{4}^{+}$+OH- | D. | NaHCO3═Na++H++CO32- |
分析 A.硫化氢为多元弱酸,是弱电解质,部分电离,分步电离,以第一步为主;
B.醋酸为弱酸,是弱电解质,部分电离;
C.一水合氨为弱电解质,部分电离产生氨根离子与氢氧根离子;
D.碳酸氢根离子为弱酸的酸式根离子,不能拆.
解答 解:A.硫化氢属于弱电解质,部分电离,分步电离,以第一步为主,电离方程式:H2S?H++HS-,故A错误;
B.醋酸为弱酸,是弱电解质,部分电离,电离方程式:CH3COOH?H++CH3COO-,故B正确;
C.一水合氨为弱电解质,部分电离产生氨根离子与氢氧根离子,离子方程式:NH3+H2O?NH3•H2O?NH4++OH-,故C错误;
D.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,注意多元弱酸分步电离,以第一步为主.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.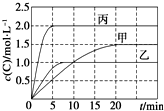 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和如图表示:下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | 若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T1℃,起始时甲容器中充入0.5 mol A、1.5 mol B,平衡时A的转化率为25% |
4.金属A和非金属B可以直接化合生成化合物AxBy.甲、乙两同学分别做A和B化合的实验,每人所用A和B的质量不相同,但总质量都是12g,甲、乙所用A、B质量和得到的化合物AxBy的质量如下:
则A、B所发生的反应可能为( )
| A | B | AxBy | |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
| A. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO | B. | Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS | ||
| C. | 3Fe+2O2$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4 | D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 |
11.在标况下,下列气体体积最大的是( )
| A. | 14gCO | B. | 32gO2 | C. | 44gCO2 | D. | 4gH2 |
8.如表实验现象所对应的离子方程式正确的是( )
| 实验 | 现象 | 离子方程式 | |
| A | 稀硫酸滴入含酚酞的Ba(OH)2溶液中 | 白色沉淀生成,溶液由红色变无色 | Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| B | 磁性氧化铁(Fe3O4)溶于氢碘酸 | 磁性氧化铁溶解,溶液变棕黄色 | Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C | Ca(OH)2澄清溶液加到氯水中 | 溶液由黄绿色变为无色 | Cl2+2Ca(OH)2═Cl-+ClO-+Ca2++H2O |
| D | 稀硫酸加到KI淀粉溶液中 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
9.北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
1KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中反应所产生的I2的物质的量是1.0×10-5mol.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中反应所产生的I2的物质的量是1.0×10-5mol.
 (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4