题目内容
5.下列叙述正确的是( )| A. | 钾、钠、镁等活泼金属着火时,可用泡沫灭火器灭火 | |
| B. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 | |
| C. | 除去铝粉中混有的铜粉,可先用浓硝酸溶解,然后再过滤、洗涤、干燥 | |
| D. | Ba2+浓度较高时危害健康,BaCO3不能作为造影剂用于X-射线检查肠胃道疾病 |
分析 A.过氧化钠、过氧化钾与二氧化碳反应,镁可在二氧化碳中燃烧;
B.二氧化氮和溴都能把碘离子氧化生成碘单质;
C.铝和浓硝酸发生钝化反应,铜粉能溶解在浓硝酸中;
D.Ba2+浓度较高时危害健康,BaCO3能与胃液中的盐酸反应生成BaCl2,BaCl2是重金属盐,易溶于水,使人中毒.
解答 解:A.过氧化钠、过氧化钾与二氧化碳反应,镁可在二氧化碳中燃烧,则钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火,一般可用沙子扑灭,故A错误;B.二氧化氮和溴都能把碘离子氧化生成碘单质,碘遇湿润的淀粉碘化钾试纸变蓝色,所以不能用湿润的淀粉碘化钾试纸区别二氧化氮和溴蒸气,故B错误;
C.除去铝粉中混有的铜粉,先用浓硝酸溶解,铝和浓硝酸发生钝化反应,铜粉和浓硝酸反应生成易溶于水的硝酸铜,除去铝粉中混有的铜粉,可先用浓硝酸溶解,然后再过滤、洗涤、干燥得到铝,故C正确;
D.BaCO3能与胃液中的盐酸反应,反应的化学方程式为:BaCO3+2HCl═BaCl2+H2O+CO2↑,生成易溶于水的氯化钡会使人发生蛋白质变性中毒,BaCO3不能作为造影剂用于X-射线检查肠胃道疾病,故D正确;
故选CD.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.某市场销售的某种食用精制盐包装袋上有如下说明:
(1)I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(2)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
①Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(2)已知:I2+2S2O32-═2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
13.卤代烃发生消去反应,需要的反应条件是( )
| A. | 氢氧化钠的水溶液 | B. | 氢氧化钠的醇溶液 | ||
| C. | 浓硫酸、加热 | D. | 铜、加热 |
20.青蒿酸是合成青蒿素的原料,其结构如图所示.下列有关青蒿酸的说法正确的是( )
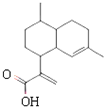

| A. | 青蒿酸分子式为:C15H20O2 | |
| B. | 在一定条件,可与乙醇发生酯化反应 | |
| C. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
17.绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )

| A. | 1 mol绿原酸与足量NaHCO3溶液反应,生成3 mol CO2气体 | |
| B. | 1 mol绿原酸与足量溴水反应,最多消耗2.5 mol Br2 | |
| C. | 1 mol绿原酸与足量NaOH溶液反应,最多消耗4 mol NaOH | |
| D. | 绿原酸水解产物均可以与FeCl3溶液发生显色反应 |
14.某同学用图甲所示装置及器材,测定碳酸钙与盐酸反应生成CO2气体体积随反应时间变化情况,并绘制出图乙所示曲线.有关分析不正确的是( )


| A. | CaCO3与盐酸的反应为放热反应 | |
| B. | 收集气体最多的时间段为t1~t2 | |
| C. | 平均反应速率:v(t1~t2)>v(t2~t3)>v(0~t1)>v(t3~t4) | |
| D. | 在t4后,收集到的CO2气体不再增加,一定是碳酸钙已完全反应 |
15.下列反应中生成物总能量高于反应物总能量的是( )
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 乙烯与氧气的反应 | ||
| C. | 盐酸与NaOH溶液的反应 | D. | 铝粉与氧化铁粉末的铝热反应 |