题目内容
8.新型高能钠硫电池以熔融的钠、硫为电极,以钠离子导电的陶瓷为固体电解质,该电池放电时为原电池,充电时为电解池,反应原理为:2Na+xS=Na2Sx.请回答下列问题:
(1)放电时S发生还原反应,Na为负极
(2)充电时Na所在电极与直流电源负极相连
(3)充电时阳极反应为:Sx2--2e-=xS;放电时负极反应为Na-e-=Na+.
(4)用此电池电解饱和NaCl溶液,当阳极产生11.2L(标准状况)气体时,消耗金属钠23g.
分析 在放电时,原电池正极发生得电子的还原反应,在反应2Na+xS=Na2Sx中,硫单质得电子,故正极反应为:xS+2e-=Sx2-;原电池负极发生失电子的氧化反应,在反应2Na+xS=Na2Sx中钠失电子,故负极反应为2Na-2e-=2Na+,在充电时,电解池的阳极发生的电极反应极为正极上的逆反应,阴极反应和负极互为逆反应,根据电极反应以及电子守恒进行计算即可.
解答 解:(1)在反应2Na+xS=Na2Sx中钠失电子,故放电时硫单质得电子发生还原反应,钠单质失电子,作负极,故答案为:还原;负;
(2)充电时Na所在电极为电池的负极应该与直流电源的负极相连,故答案为:负;
(3)充电时,阳极发生失电子的氧化反应,电极反应式为Sx2--2e-=xS,原电池负极发生失电子的氧化反应,在反应2Na+xS=Na2Sx中钠失电子,故负极反应为Na-e-=Na+;故答案为:Sx2--2e-=xS;Na-e-=Na+;
(4)电源电解饱和NaCl溶液,当阳极产生11.2L即0.5mol(标准状况)气体时,根据电极反应:2Cl--2e-=Cl2↑,转移电子是1mol,根据电极反应:Na-e-=Na+,所以耗金属钠的质量是1mol×23g/mol=23g,故答案为:23.
点评 本题考查学生原电池、电解池的工作原理等知识,注意电子守恒的应用是关键,难度中等.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
19.把炭和氧化铜组成的混合物隔绝空气加热,充分反应后称量所得剩余固体的质量为112g,向此剩余固体中加入200g稀硫酸,稀硫酸恰好被完全反应,过滤后所得滤渣呈红色.同时将反应所得的气体全部通入含溶质37g的澄清石灰水中,得到沉淀25g.下列有关说法正确的是( )
| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
16.下列实验误差分析错误的是( )
| A. | 用湿润的pH试纸测稀碱液的,测定值偏小 | |
| B. | 用量筒量取10mLNaOH 溶液时,俯视刻度.量出的体积大于10mL | |
| C. | 使用天平称量时不小心将药品与砝码的位置放反了,称最结果可能是准确的 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
9.根据电解质在溶液中的电离情况,我们划分出了酸、碱、盐,通过学习我们知道酸和碱都有通性,而盐是没有通性的,其本质原因是( )
| A. | 盐不能电离出阳离子 | B. | 盐不能电离出阴离子 | ||
| C. | 盐不能电离出H+或OH- | D. | 盐不能电离出共同的离子 |

 .
.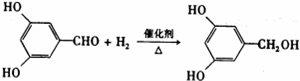 ;反应类型:加成反应.
;反应类型:加成反应.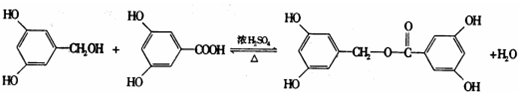 ;反应类型:酯化反应
;反应类型:酯化反应
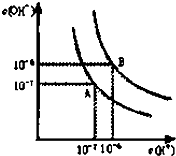 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: