题目内容
5.纯碱是造纸、玻璃、纺织、制革等行业的重要原料.(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙和CO生成,第②步反应中每得到1molLNa2CO3转移电子的总物质的量为8mol.
(2)索尔维法制纯碱的主要工艺流程如下,石灰石用于制备CO2和石灰乳.
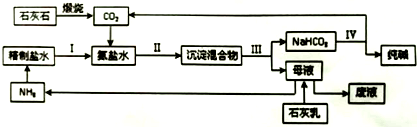
①原盐水中含少量Mg2+和Ca2+,结合生产实际,精制盐水需要的试剂是Ca(OH)2(或CaO)、Na2CO3(填化学式).
②步骤Ⅱ保持在30~35℃进行,反应的化学方程式为NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl);该工艺中循环利用的物质是NH3、CO2.
③索尔维法制纯碱不需要用到的一种设备是B(填选项字母).
A.石灰窑 B.沸腾炉 C.碳酸化塔 D.蒸氨塔 E.吸氨塔
④该工艺中没有涉及的基本化学反应类型是C(填选项字母).
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)我国科学家侯德榜将合成氨工业得到的NH3与CO2引入纯碱的生产,向索尔维法制纯碱工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品NH4Cl(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率.
(4)纯碱产品中可能含有碳酸氢钠,用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NaHCO3)=$\frac{84(m1-m2)}{31m1}$(m1是样品质量,m2是样品受热分解后的质量).(列出算式,所需数据用字母表示,并说明各字母的含义)
分析 (1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS+4CO↑,根据碳酸钠和转移电子之间的关系式计算转移电子物质的量;
(2)石灰石煅烧发生的反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,精盐溶液中通入氨气,氨气和水反应生成一水合氨,将CO2通入氨盐水中发生反应NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因为碳酸氢钠溶解度小于碳酸氢铵,所以得到NaHCO3沉淀,过滤得到NaHCO3,向母液中加入Ca(OH)2得到NH3,将NaHCO3分解得到Na2CO3和CO2,反应中CO2和NH3能重复利用; ①镁离子用石灰乳或生石灰除去、钙离子用碳酸根离子除去;
②碳酸氢钠溶解度小于碳酸氢铵,所以氨气、二氧化碳和水、NaCl反应生成溶解度较小的NaHCO3;
在流程图中能参加反应且能生成的物质能循环利用;
③根据各设备的用途判断;
④煅烧石灰石、加热碳酸氢钠都发生分解反应,氨气和水反应为化合反应,碳酸氢铵和氯化钠 发生复分解反应;
(3)加入氨气和氯化钠后还生成可溶性的铵盐;
(4)称量样品的质量,加热分解完成,测定分解后样品质量,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
解答 解:(1)将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成,S元素发生还原反应,C发生氧化反应生成CO,反应方程式为:Na2SO4+CaCO3+4C $\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS+4CO↑,该反应中C元素化合价由0价变为+2价、S元素化合价由+6价变为-2价,则转移电子个数是8,即生成1mol碳酸钠转移8mol电子,
故答案为:8mol;
(2)石灰石煅烧发生的反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,精盐溶液中通入氨气,氨气和水反应生成一水合氨,将CO2通入氨盐水中发生反应NaCl+NH4HCO3=NaHCO3↓+NH4Cl,因为碳酸氢钠溶解度小于碳酸氢铵,所以得到NaHCO3沉淀,过滤得到NaHCO3,向母液中加入Ca(OH)2得到NH3,将NaHCO3分解得到Na2CO3和CO2,反应中CO2和NH3能重复利用;
①用石灰乳或生石灰与镁离子溶液反应生成氢氧化镁沉淀而除去镁离子,用碳酸钠溶液和钙离子反应生成碳酸钙沉淀而除去钙离子,
故答案为:Ca(OH)2(或CaO);Na2CO3;
②碳酸氢钠溶解度小于碳酸氢铵,所以氨气、二氧化碳和水、NaCl反应生成溶解度较小的NaHCO3,反应方程式为NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl),在流程图中能参加反应且能生成的物质能循环利用,能循环利用的物质有CO2和NH3,故答案为:NH3+H2O+NaCl+CO2=NaHCO3↓+NH4Cl(或NH3•H2O+NaCl+CO2=NaHCO3↓+NH4Cl);CO2和NH3;
③石灰窑煅烧石灰石、碳酸化塔吸收二氧化碳、蒸氨塔蒸发母液得到氨气、吸氨塔吸收氨气,所以没有用到的是沸腾炉,故选B;
④煅烧石灰石、加热碳酸氢钠都发生分解反应,氨气和水反应为化合反应,碳酸氢铵和氯化钠 发生复分解反应,所以没有涉及的反应是置换反应,故选C;
(3)加入氨气和氯化钠后还生成可溶性的铵盐,为NH4Cl,故答案为:NH4Cl;
(4)称量样品的质量m1,加热分解完成,测定分解后样品质量m2,根据固体质量差可以计算碳酸氢钠的质量,进而计算样品中碳酸氢钠的质量分数.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量差
168 62
m (m1-m2)
则m=$\frac{168(m1-m2)}{62}$,
故样品中碳酸氢钠的质量分数为$\frac{\frac{168(m1-m2)}{62}}{m1}$=$\frac{84(m1-m2)}{31m1}$,
故答案为:$\frac{84(m1-m2)}{31m1}$( m1是样品质量,m2是样品受热分解后的质量).
点评 本题以氯碱工业为载体考查物质制备,为高频考点,明确流程图中发生的反应、用到的装置、物质的性质是解本题关键,注意:向食盐水中通入氨气和二氧化碳时应该先通入氨气后通入二氧化碳,因为氨气溶解性大、二氧化碳溶解性小,为易错点.本题考查化学与技术,关键是对原理的理解,涉及物质的分离提纯、物质含量测定等,理解掌握中学常见化学工业,难度中等.

| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
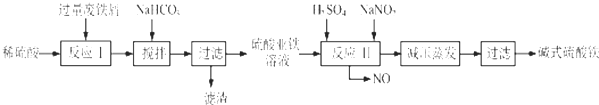
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:回答下列问题:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中的离子方程式为Fe2++2H++NO2-=Fe3++NO↑+H2O,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是2H2O+4NO+O2=4HNO3.(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是防止蒸发时温度过高,碱式硫酸铁进一步水解生成Fe(OH)3.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
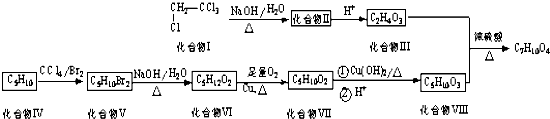
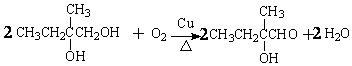 .
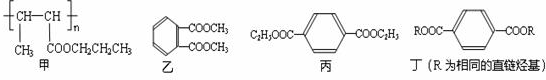
.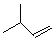 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为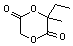 .
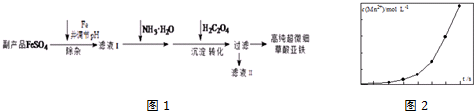
.
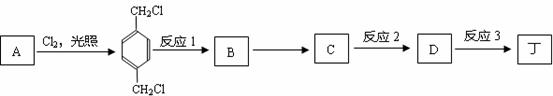
 .
.
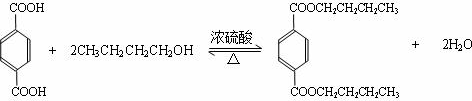 .
.