题目内容
19.把炭和氧化铜组成的混合物隔绝空气加热,充分反应后称量所得剩余固体的质量为112g,向此剩余固体中加入200g稀硫酸,稀硫酸恰好被完全反应,过滤后所得滤渣呈红色.同时将反应所得的气体全部通入含溶质37g的澄清石灰水中,得到沉淀25g.下列有关说法正确的是( )| A. | 生成气体的质量可能是11克或33克 | |
| B. | 滤渣中的红色物质可能是32克或96克 | |
| C. | 参与反应的氧化铜质量可能是40克或120克 | |
| D. | 稀硫酸的溶质质量可能是38.4克或115.2克 |
分析 氢氧化钙和少量二氧化碳反应生成碳酸钙的反应为Ca(OH)2+CO2═CaCO3↓+H2O,二氧化碳过量时碳酸钙部分溶解,发生反应为CaCO3+H2O+CO2═Ca(HCO3)2,
A.当二氧化碳不足时,只发生反应Ca(OH)2+CO2═CaCO3↓+H2O,据此计算出生成二氧化碳的质量;当二氧化碳稍过量时,发生反应Ca(OH)2+CO2═CaCO3↓+H2O、CaCO3+H2O+CO2═Ca(HCO3)2,据此计算出生成二氧化碳的质量;
B.氧化铜和碳反应的化学方程式及其质量关系为:
2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
128 44
分别根据二氧化碳为11g、33g计算出滤渣中的红色物质的质量;
C.2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
160 44
分别根据二氧化碳为11g、33g计算参与反应的氧化铜的可能质量;
D.不知剩余氧化铜的质量,无法判断稀硫酸中的溶质质量.
解答 解:氢氧化钙和二氧化碳反应生成碳酸钙的反应为:Ca(OH)2+CO2═CaCO3↓+H2O,二氧化碳过量时碳酸钙部分溶解,反应的化学方程式为:CaCO3+H2O+CO2═Ca(HCO3)2,
A.如果二氧化碳不足,碳酸钙是25g,根据反应可知生成二氧化碳的质量为:25g×$\frac{44}{100}$=11g;
如果二氧化碳过量,37g氢氧化钙和二氧化碳反应生成50g碳酸钙沉淀,然后过量的二氧化碳溶解(50-25)g=25g碳酸钙,则总共消耗二氧化碳的质量为:$\frac{37}{74}$×44g+$\frac{25}{100}$×44g=33g,故A正确;
B.氧化铜和碳反应的化学方程式及其质量关系为:
2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
128 44
如果生成的一氧化碳是11g时,根据氧化铜和碳反应的化学方程式可以计算出生成的铜的质量是32g,如果生成的二氧化碳是33g时,根据氧化铜和碳反应的化学方程式可以计算出生成的铜的质量是96g,故B正确;
C.2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,
160 44
如果生成的一氧化碳是11g时,根据氧化铜和碳反应的化学方程式可以计算出反应的氧化铜的质量是40g,如果生成的一氧化碳是33g时,根据氧化铜和碳反应的化学方程式可以计算出反应的氧化铜的质量是120g,故C正确;
D.由于不知剩余氧化铜的质量,因此无法判断稀硫酸中的溶质质量,故D错误;
故选ABC.
点评 本题考查混合物反应的计算,题目浓度较大,明确发生反应的实质为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
| A. | 明矾净水过程中不涉及化学变化 | B. | 金属与盐溶液反应都是置换反应 | ||
| C. | 化合反应一定有单质参加反应 | D. | 石油分馏和碘的升华都是物理变化 |
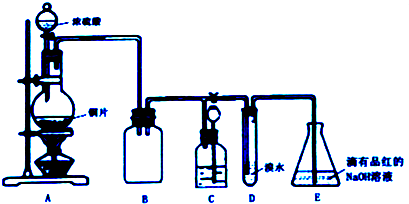
(1)装置A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置B的作用是防止C中液体倒吸入A中(或防倒吸,或安全瓶).
(2)设计装置D的目的是验证SO2的还原性,E中NaOH全部转化为NaHSO3的标志是溶液红色褪去.
(3)装置C的作用是贮存多余的气体,C中应放置的液体是饱和NaHSO3溶液.
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到目的是b c(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
| A. | 2.0g H218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,60g丙醇中存在的共价键总数为10NA | |
| C. | 1 molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有C-Cl键数目为0.3NA |
①
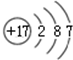 ②
②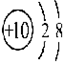 ③
③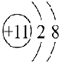 ④
④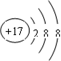
| A. | ①②两种粒子所属的元素在元素周期表的同一横行 | |
| B. | ②③④对应的元素化学性质相似 | |
| C. | ①③对应的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
 ;
;