题目内容
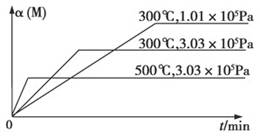
在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2 N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
 N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是
N2O4(正反应为放热反应),若把烧瓶置于100℃的沸水中,下列情况:①颜色,②平均相对分子质量,③质量,④压强,⑤密度。其中不变的是| A.②④ | B.③④ | C.③⑤ | D.①③ |
C
试题分析:可逆反应2NO2
 N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,①二氧化氮的浓度增大,颜色加深;②混合气体总的物质的量增大,混合气体总的质量不变,根据M=
N2O4,正反应为放热反应,升高温度,化学平衡向着逆反应方向移动,①二氧化氮的浓度增大,颜色加深;②混合气体总的物质的量增大,混合气体总的质量不变,根据M= 可知,混合气体的平均相对分子质量减小;③反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变;④升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ=
可知,混合气体的平均相对分子质量减小;③反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变;④升高温度,化学平衡向左移动,混合气体总的物质的量增大、混合气体的温度升高,容器的容积不变,根据pV=nRT可知,容器内压强增大;⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,容器的容积不变,根据ρ= 可知,混合气体的密度不变,故选:C。
可知,混合气体的密度不变,故选:C。
练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2 CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是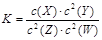 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是 2Z(g) + 2W(g)
2Z(g) + 2W(g) 3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )
3C(g)达平衡时,A、B、C的物质的量分别为3 mol,2 mol和4 mol,若温度不变,向容器内的平衡混合物中再加入A、C各1mol,此时该平衡移动的方向是( )  NH3(g)+HI(g);
NH3(g)+HI(g); 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。