题目内容
铁的化合物在化学研究中受到广泛重视,请回答下列问题:
(1)一种光敏材料的化学式是KxFe(C2O4)y?3H2O ( Fe 为+3 价),为测定其组成,称取一定质量的晶体置于烧杯中,加入足量的蒸馏水和稀 H2SO4,将 C2O42-转化为 H2C2O4后用 0.1020mol/L的KMnO4溶液滴定,当消耗 KMnO4溶液 24.48mL 时恰好完全反应(已知该反应H2C2O4 和MnO4-分别生成CO2和Mn2+);再向溶液中加入适量的还原剂,恰好将 Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,当 Fe2+完全被氧化时,用去 KMnO4溶液 4.08mL(产物为Fe3+和Mn2+).通过计算确定该材料的组成 .
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为 .
(3)纳米级Fe3O4是磁流体中的重要粒子,其制备原理可简单表示如下:
①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中生成两种碱,写出该反应过程的离子方程式 .②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为 .
(4)复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4
MnFe2O4-x+
O2↑ MnFe2O4-x+xH2O→MnFe2O4+xH2↑,
若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为 .
(1)一种光敏材料的化学式是KxFe(C2O4)y?3H2O ( Fe 为+3 价),为测定其组成,称取一定质量的晶体置于烧杯中,加入足量的蒸馏水和稀 H2SO4,将 C2O42-转化为 H2C2O4后用 0.1020mol/L的KMnO4溶液滴定,当消耗 KMnO4溶液 24.48mL 时恰好完全反应(已知该反应H2C2O4 和MnO4-分别生成CO2和Mn2+);再向溶液中加入适量的还原剂,恰好将 Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,当 Fe2+完全被氧化时,用去 KMnO4溶液 4.08mL(产物为Fe3+和Mn2+).通过计算确定该材料的组成
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为
(3)纳米级Fe3O4是磁流体中的重要粒子,其制备原理可简单表示如下:
①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中生成两种碱,写出该反应过程的离子方程式
(4)复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4
| >1000K |
| x |
| 2 |
若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为
考点:化学方程式的有关计算,铁的氧化物和氢氧化物,铁盐和亚铁盐的相互转变
专题:计算题
分析:(1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,根据关系式:5C2O42-~5H2C2O4~2KMnO4计算n(C2O42-),再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-计算n(Fe3+),根据n (Fe3+):n (C2O42-)确定y的值,再根据电荷守恒确定x,进而确定化学式;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水;
(4)根据化合价代数和为0,计算MnFe2O4-x中铁的总价态,令1mol MnFe2O4-x中含Fe2+、Fe3+物质的量分别为xmol、ymol,列方程组解答.
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水;
(4)根据化合价代数和为0,计算MnFe2O4-x中铁的总价态,令1mol MnFe2O4-x中含Fe2+、Fe3+物质的量分别为xmol、ymol,列方程组解答.
解答:
解:(1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,根据关系式:5C2O42-~5H2C2O4~2KMnO4,可知n(C2O42-)=
n(MnO4-)=
×0.1020×24.48×10-3 mol,
再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-,可知n (Fe3+)=n( Fe2+)=5n(MnO4-)=5×0.1020×4.08×10-3 mol,
故n (Fe3+):n (C2O42-)=1:3,所以y=3,由电荷守恒可知x+3=2y,即x+3=3×2,解得x=3,
故化学式为 K3Fe(C2O4)3?3H2O,
故答案为:K3Fe(C2O4)3?3H2O;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵,反应离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水,化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O;
(4)x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,设1mol MnFe2O3.4中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有x+y=2,2x+3y=4.8,联立解得:x=1.2,y=0.8,
则1mol MnFe2O3.6中含Fe2+的物质的量为1.2mol,则Fe2+占的百分率为
×100%=60%.
故答案为:60%.
| 5 |
| 2 |
| 5 |
| 2 |
再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-,可知n (Fe3+)=n( Fe2+)=5n(MnO4-)=5×0.1020×4.08×10-3 mol,
故n (Fe3+):n (C2O42-)=1:3,所以y=3,由电荷守恒可知x+3=2y,即x+3=3×2,解得x=3,
故化学式为 K3Fe(C2O4)3?3H2O,
故答案为:K3Fe(C2O4)3?3H2O;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵,反应离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水,化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O;
(4)x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,设1mol MnFe2O3.4中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有x+y=2,2x+3y=4.8,联立解得:x=1.2,y=0.8,
则1mol MnFe2O3.6中含Fe2+的物质的量为1.2mol,则Fe2+占的百分率为
| 1.2mol |
| 2mol |
故答案为:60%.
点评:本题考查氧化还原反应滴定计算、方程式书写、物质组成的计算等,(1)中计算量较大,注意利用关系式计算,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
某反应的反应物浓度在5min内由6mol/L 变成了2mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A、4 mol/L |
| B、4 mol/(L?min) |
| C、0.8 mol/L |
| D、0.8 mol/(L?min) |
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: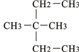 ③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥
③CH2=CH-CH3 ④氧气 ⑤氯水 ⑥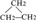 ⑧氯气 ⑨CH3CH2OH ⑩臭氧?
⑧氯气 ⑨CH3CH2OH ⑩臭氧?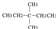 ?CH≡CH?
?CH≡CH?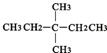 ?H2
?H2