题目内容
下列各组物质的分离或提纯,应选用下述方法的哪一种?(填序号)
A、分液 B、过滤 C、加热分解 D、蒸馏
(1)用自来水制取蒸馏水 ;
(2)除去碳酸钠中含有少量的碳酸氢钠 ;
(3)分离植物油和水 ;
(4)分离氯化钾溶液和沙子的混合物 .
A、分液 B、过滤 C、加热分解 D、蒸馏
(1)用自来水制取蒸馏水
(2)除去碳酸钠中含有少量的碳酸氢钠
(3)分离植物油和水
(4)分离氯化钾溶液和沙子的混合物
考点:物质的分离、提纯和除杂
专题:化学实验基本操作
分析:分液用于分离互不相溶的液体;过滤用于分离不溶性固体和液体;萃取用于分离在不同溶剂中的溶解度不同的溶质;蒸馏用于分离沸点不同的液体混合物;蒸发用于分离可溶性固体和液体的混合物,分离溶解度不同的混合物,可用结晶的方法分离;当物质具有热不稳定性时,可用加热分解的方法分离.
解答:
解:(1)可用蒸馏的方法制备蒸馏水,故答案为:D;
(2)碳酸氢钠受热易分解生成碳酸钠,碳酸钠受热稳定,故答案为:C;
(3)植物油和水互不相溶,可用分液的方法分离,故答案为:A;
(4)沙子难溶于水,沙子易溶于水,应用过滤的方法分离,故答案为:B.
(2)碳酸氢钠受热易分解生成碳酸钠,碳酸钠受热稳定,故答案为:C;
(3)植物油和水互不相溶,可用分液的方法分离,故答案为:A;
(4)沙子难溶于水,沙子易溶于水,应用过滤的方法分离,故答案为:B.
点评:本题考查物质的分离和提纯,题目难度不大,注意根据物质的性质的异同选择分离方法,学习中要注意相关基础知识的全面掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
各组混合物,不管它们以任何比例混合,只要总质量固定,完全燃烧后所得的CO2的量为常量,则该组有机物为( )
| A、甲醛和乙酸 |
| B、丁烯和丁烷 |
| C、甲醇和乙醇 |
| D、乙醇和乙醚 |
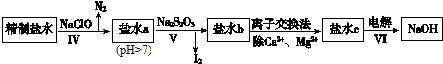
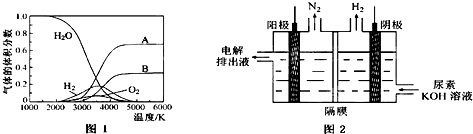
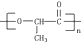 由一种单体缩聚而成的,该单体的结构简式为
由一种单体缩聚而成的,该单体的结构简式为