题目内容
11.除去下列物质中所含的少量杂质的方法正确的是( )| 选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和 Na2CO3 溶液 | 洗气 |
| C | 乙烷 | 乙烯 | 酸性 KMnO4 溶液 | 洗气 |
| D | 蛋白质 | 葡萄糖 | 浓 (NH4)2SO4 溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者均不溶于水;
B.二者均与碳酸钠溶液反应;
C.乙烯被高锰酸钾氧化后生成二氧化碳;
D.蛋白质遇(NH4)2SO4 溶液发生盐析,为可逆过程.
解答 解:A.二者均不溶于水,则利用水不能除杂,故A错误;
B.二者均与碳酸钠溶液反应,不能除杂,应选饱和碳酸氢钠溶液、洗气,故B错误;
C.乙烯被高锰酸钾氧化后生成二氧化碳,引入新杂质,不能除杂,应选溴水、洗气,故C错误;
D.蛋白质遇(NH4)2SO4 溶液发生盐析,为可逆过程,则盐析、过滤、洗涤可分离,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意除杂的原则,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
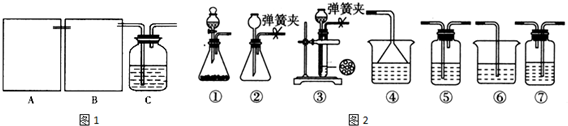
1.丙烯酸甲酯是一种重要的工业原料,某实验小组制取丙烯酸甲酯的装置如图1所示:
CH2=CHCOOH+HOCH3→CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:
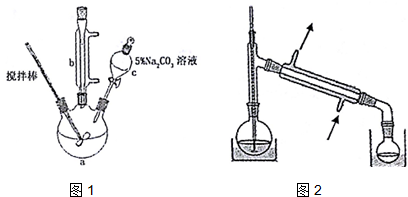
回答下列问题:
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10-00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
CH2=CHCOOH+HOCH3→CH2=CHCOOCH3+H2O
①取10.0g丙烯酸和6.0g甲醇放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70-90℃馏分.
可能用到的信息:

| 沸点 | 溶解性 | ||
| 丙烯酸 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5%0Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸和甲醇(降低丙烯酸甲酯的溶解度).
(3)请写出配制100g 5% Na2CO3溶液所使用的玻璃仪器烧杯、玻璃棒、量筒.
(4)关于产品的蒸馏操作(夹持装置未画出),图2中有2处错误,请分别写出温度计水银球位置、尾接管与锥形瓶接口密封.
为检验产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10-00mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCI溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(5)计算本次酯化反应丙烯酸的转化率54.0%.
(6)请列举2条本实验中需要采取的安全防护措施通风橱中实验、防止明火.
2.在25.00ml碱式滴定管中盛有溶液,液面恰好在20.00ml刻度处,现将滴定管中全部溶液放出,流入量筒内,所得溶液体积为( )
| A. | 5mL | B. | 20mL | C. | 大于5mL | D. | 小于5mL |
19.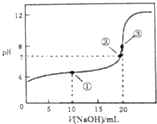 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
 常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | ①处水的电离程度大于②处水的电离程度 | |
| C. | ②处加入的NaOH溶液恰好将CH3COOH中和 | |
| D. | ③处所示溶液:c(Na+)<c(CH3COO-) |
3.下列说法不正确的是( )
| A. | 粗铜电解精炼时,应将粗铜与直流电源的正极相连 | |
| B. | 金属的吸氧腐蚀的过程中,正极的电极反应式为O2+4e-+2H2O═4OH- | |
| C. | 燃料电池中加入燃料的电极一定是电池的负极 | |
| D. | 在生产生活中,为保护钢铁器件免受腐蚀,应将该器件与直流电源的正极相连 |
20.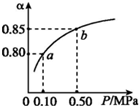 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
 已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )
已知2A(g)+B(g)?n C(g),在密闭容器中进行,K(300℃)>K(350℃),某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A. | 该反应正反应是吸热反应 | |
| B. | 反应温度升高,A的转化率增大 | |
| C. | 平衡状态由a变到b时,化学平衡常数K(A)小于K(B) | |
| D. | 容器内气体的平均相对分子质量不变,说明反应达到化学平衡状态 |
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号表示):