题目内容
下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
| (I) | (Ⅱ) | |
| A | 少量SO2通人Ba(OH)2溶液 | 过量SO2通入少量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1molCl2通人含0.2molFeBr2的溶液 | 0.3molCl2通入0.2mol FeBr2溶液中 |
| D | 过量BaCl2溶液与少量Na2SO3溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
| A、A | B、B | C、C | D、D |
考点:离子方程式的书写
专题:
分析:A.二氧化硫和氢氧化钡反应,少量二氧化硫反应生成亚硫酸盐,二氧化硫过量生成亚硫酸氢盐;
B.氨水和铝盐反应生成氢氧化铝沉淀,氢氧化铝沉淀不溶于氨水;
C.氯气量不同氧化的离子不同,离子方程式不同;
D.氢氧化钡和硫酸镁反应除生成硫酸钡沉淀还生成氢氧化镁沉淀.
B.氨水和铝盐反应生成氢氧化铝沉淀,氢氧化铝沉淀不溶于氨水;
C.氯气量不同氧化的离子不同,离子方程式不同;
D.氢氧化钡和硫酸镁反应除生成硫酸钡沉淀还生成氢氧化镁沉淀.
解答:
解:A.将少量SO2通入Ba(OH)2溶液生成亚硫酸钡沉淀,将过量SO2通入少量Ba(OH)2溶液生成亚硫酸氢钡,无沉淀生成,故A错误;
B.将少量浓氨水滴入Al2(SO)4溶液和将少量Al2(SO4)3溶液滴入浓氨水可以用同一离子方程式表示,Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故B正确;
C.将0.1mol Cl2通入含0.2molFeBr2的溶液中,发生反应为2Fe2++Cl2=2Fe3++2Cl-;将0.3mol Cl2通入含0.2mol FeBr2溶液反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;故C错误;
D.将过量BaCl2溶液与少量Na2SO4溶液相混合离子方程式为Ba2++SO42-=BaSO4↓,将少量Ba(OH)2溶液与过量MgSO4溶液相混合反应的离子方程式为Ba2++Mg2++2OH-+SO42-=BaSO4↓+Mg(OH)2↓,故D错误;
故选A.
B.将少量浓氨水滴入Al2(SO)4溶液和将少量Al2(SO4)3溶液滴入浓氨水可以用同一离子方程式表示,Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故B正确;
C.将0.1mol Cl2通入含0.2molFeBr2的溶液中,发生反应为2Fe2++Cl2=2Fe3++2Cl-;将0.3mol Cl2通入含0.2mol FeBr2溶液反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;故C错误;
D.将过量BaCl2溶液与少量Na2SO4溶液相混合离子方程式为Ba2++SO42-=BaSO4↓,将少量Ba(OH)2溶液与过量MgSO4溶液相混合反应的离子方程式为Ba2++Mg2++2OH-+SO42-=BaSO4↓+Mg(OH)2↓,故D错误;
故选A.
点评:本题考查了离子方程式的书写,题目难度中等,把握发生的化学反应为解答的关键,侧重复分解反应及与量有关的离子反应、氧化还原反应的考查,选项C为解答的难点和易错点.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
美国一个海军航空站安装了一台250kW的MCFC型燃料电池.该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800℃.已知该电池的总反应为2H2+O2═2H2O,负极反应为H2+CO32--2e-═H2O+CO2.下列推断正确的是( )
| A、正极反应为4OH--4e-═O2↑+2H2O |
| B、放电时,CO32- 向负极移动 |
| C、电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
| D、放电时CO32-向正极移动 |
下列互为同位素的是( )
| A、H2 D2 |
| B、14N 14C |
| C、16O 17O |
| D、CO CO2 |
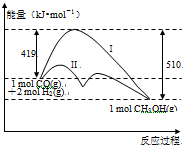 反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A、该反应的△H=+91 kJ/mol |
| B、加入催化剂,该反应的△H变小 |
| C、如果该反应生成液态CH3OH,则△H变大 |
| D、反应物的总能量大于生成物的总能量 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 过氧化钠 Na2O2 |
| B、碱 纯碱 Na2CO3 |
| C、金属氧化物 氧化铁 FeO |
| D、非金属氧化物 三氧化硫 SO3 |


