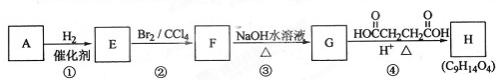
题目内容
现有份碳酸钠与碳酸氢钠混合固体,取样品29.6克,与足量盐酸充分反应,得到6.72升气体(标况),则碳酸钠的质量分数为 .
考点:有关混合物反应的计算
专题:计算题
分析:根据n=
计算出标况下6.72L二氧化碳的物质的量,设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,然后分别根据总质量、C原子守恒列式计算出碳酸钠、碳酸氢钠的物质的量,再计算出混合物中碳酸钠的质量分数.
| V |
| 22.4L/mol |
解答:
解:碳酸钠、碳酸氢钠与足量盐酸反应生成的气体为二氧化碳,标况下6.72L二氧化碳的物质的量为:n(CO2)=
=0.3mol,
设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,
根据总质量可得:①106x+84y=29.6,
根据C原子守恒可得:②x+y=0.3mol,
根据①②联立解得:
,
混合物中碳酸钠的质量分数为:ω(Na2CO3)=
×100%≈71.6%,
故答案为:71.6%.
| 6.72L |
| 22.4L/mol |
设碳酸钠的物质的量为xmol,碳酸氢钠的物质的量为ymol,
根据总质量可得:①106x+84y=29.6,
根据C原子守恒可得:②x+y=0.3mol,
根据①②联立解得:
|
混合物中碳酸钠的质量分数为:ω(Na2CO3)=
| 106g/mol×0.2mol |
| 29.6g |
故答案为:71.6%.
点评:本题考查了有关混合物的计算,题目难度不大,试题侧重基础知识的考查,注意质量守恒定律在化学计算中的应用方法,明确物质的量与摩尔质量之间关系、质量分数的表达式为解答基础.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列溶液与20mL 1mol?L-1 NaNO3溶液中NO3-物质的量浓度相等的是( )
| A、10 mL 1 mol?L-1 Mg(NO3)2溶液 |
| B、5 mL 0.8 mol?L-1 Al(NO3)3溶液 |
| C、10 mL 2 mol?L-1AgNO3溶液 |
| D、10 mL 0.5 mol?L-1 Cu(NO3)2溶液 |