题目内容
3.按要求填写表:| 分子 | a | 孤对电子数 | δ键数 | VSEPR模型 | 空间构型 |
| CO2 | 4 | 0 | 2 | 直线形 | 直线形 |
| SO2 | 6 | 1 | 2 | 四面体 | V形 |
| NH3 | 5 | 1 | 3 | 四面体 | 三角锥形 |
| CCl4 | 4 | 0 | 4 | 正四面体 | 正四面体 |
分析 根据价层电子对互斥理论确定分子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.单键中只有σ键,双键中有一个σ键和一个π 键,三键中有一个σ键和两个π 键,根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;据此分析解答.
解答 解:二氧化碳分子结构式为O=C=O,二氧化碳分子中C原子价层电子对个数是2且不含孤电子对,碳原子采取sp杂化,VSEPR模型为直线形分子,不含孤电子对,所以为直线形分子,
SO2中S原子和氧原子形成2个σ键,孤电子对个数=$\frac{1}{2}$×(6-2×2)=1,价层电子对数为=2+1=3,为sp2杂化,VSEPR模型为三角形,含1对孤电子对,分子立体构型为V形,
NH3中N原子形成3个σ键,孤对电子数为$\frac{5-3×1}{2}$=1,则为sp3杂化,VSEPR模型为四面体,且含有一个孤电子对,所以离子立体构型为三角锥形,
CCl4中氮原子杂化轨道数=σ键数+孤对电子对数=4+$\frac{4-1×4}{2}$=4,杂化轨道数4,采取sp3杂化,VSEPR模型为正四面体,含孤电子对数为0,分子形状为正四面体形;
故答案为:
| 分子 | a | 孤对电子数 | δ键数 | VSEPR模型 | 空间构型 |
| CO2 | 4 | 0 | 2 | 直线形 | 直线形 |
| SO2 | 6 | 1 | 2 | 三角形 | V形 |
| NH3 | 5 | 1 | 3 | 四面体 | 三角锥形 |
| CCl4 | 4 | 0 | 4 | 正四面体 | 正四面体 |
点评 本题考查了原子杂化方式及分子的立体构型的判断,侧重分子结构的考查,注意杂化轨道理论的理解应用,题目难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
14.下列有关有机物分离提纯或除杂的方法正确的是( )
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2 | |
| B. | 除去乙醇中的微量水可加入金属钠,使其完全反应 | |
| C. | 乙酸乙酯中有乙酸杂质,可以加入氢氧化钠溶液,充分反应后静置分液 | |
| D. | 乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥 |
15.下列四种溶液中,酸性最强的是( )
| A. | pH=14的溶液 | |
| B. | c(OH-)=1.0×10-13mol•L-1的溶液 | |
| C. | 0.6%的醋酸(ρ=1g•cm-3) | |
| D. | pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合后所得溶液 |
11.通过化学反应不能实现的是( )
| A. | 生成一种新离子 | B. | 生成一种新分子 | C. | 生成一种新核素 | D. | 生成一种新单质 |
15.下列变化是通过取代反应来实现的是( )
| A. | CH3CH2OH→CH3COOCH2CH3 | B. | CH2=CH2→CH3-CH2Br | ||
| C. | CH2=CH2+H2O $\stackrel{催化剂}{→}$ CH3CH2OH | D. |  → → |
13.我国科学家成功地研制出长期依赖进口、价格昂贵的物质${\;}_8^{18}{O_2}$,下列说法正确的是( )
| A. | 它与${\;}_8^{16}{O_2}$的物理性质完全相同 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_8^{18}{O_2}$与${\;}_8^{16}{O_2}$互为同位素 | |
| D. | 1mol${\;}_8^{18}{O_2}$分子中含有20mol电子 |
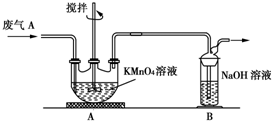 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.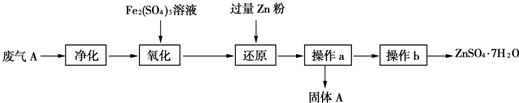

 .
.