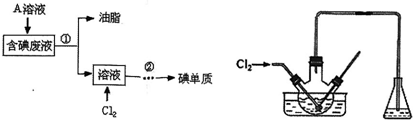
题目内容
7.空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下: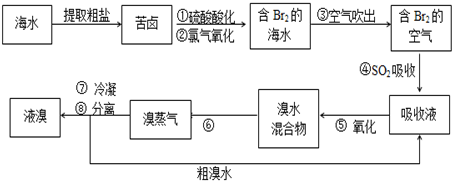
(1)步骤②发生反应的离子方程式为Cl2+2Br-═2Cl-+Br2.氯气氧化后得含溴的海水为何不直接用进行分离得到液溴,而要经过“空气吹出、S02吸收、氯化”的原因是氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,空气吹出,SO2吸收、氧化的过程实际上是一个Br2的浓缩过程.
(2)步骤④发生反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-.
(3)步骤⑥的名称是蒸馏.
(4)从含溴水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是:3Na2CO3+3Br2═NaBrO3+5NaBr+3CO2;吸收1mol Br2 时,转移的电子数为$\frac{5}{3}$mol.纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出.
(5)化学上将SCN-、OCN-、CN-等离子称为“类卤离子”.现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失.血红色消失过程中发生反应的离子方程式为2Fe(SCN)3+SO2+2H2O=2Fe2++SO42-+6SCN-+4H+或2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 (1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,氯气能将溴离子氧化为溴单质,即Cl2+2Br-=Br2+2Cl-;
(2)根据了SO2的还原性和氯气的氧化性来书写二者之间的反应;
(3)沸点不同的互溶物质的分离可以采用蒸馏法;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(5)根据信息:SCN-称为“类卤离子”,结合反应Br2+SO2+2H2O=4H++2Br-+SO42-来回答,另一种原因是三价铁离子与二氧化硫发生氧化还原反应生成了二价铁离子.
解答 解:(1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,氯气能将溴离子氧化为溴单质,即Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(2)SO2和氯气、水反应生成硫酸和氢溴酸,即:Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)溴水的混合物中,将溴单质和水分离得到溴蒸汽可以采用蒸馏法,
故答案为:蒸馏;
(4)反应中Br2起氧化剂、还原剂作用,根据关系式可知,
3Br2~NaBrO3~5NaBr~5e-,
3 5
1mol $\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
(5)将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失,因为SCN-称为“类卤离子”,根据反应:Br2+SO2+2H2O=4H++2Br-+SO42-,推得,红色消失的过程中发生反应:2Fe(SCN)3+SO2+2H2O=2Fe2++SO42-+6SCN-+4H+,
还有一种可能是三价铁离子与二氧化硫发生氧化还原反应生成了二价铁离子:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe(SCN)3+SO2+2H2O=2Fe2++SO42-+6SCN-+4H+或2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.

| A. | 玻璃、水晶和陶瓷都是传统硅酸盐材料 | |
| B. | 可溶性铝盐和铁盐可用作净水剂 | |
| C. | SO2和NO都能形成酸雨而破坏环境 | |
| D. | CO2和CH4都是引起温室效应的气体 |
| A. | 汽油 | B. | 甘油 | C. | 煤油 | D. | 柴油 |
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |
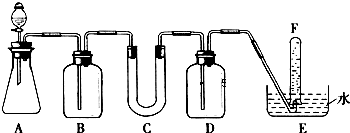
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
在此反应中,过氧化钠的作用是③(填序号) ①氧化剂;②还原剂;③既是氧化剂又是还原剂;④既不是氧化剂,又不是还原剂.
(4)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
| A. | B的最高价氧化物对应的水化物的酸性比E强 | |
| B. | 某物质焰色反应呈黄色,该物质一定是含C的盐 | |
| C. | 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红 | |
| D. | B的氢化物的沸点一定高于A的氢化物 |