题目内容
3.某气态烃0.5mol能与1mol HCl完全加成,加成后产物分子中的氢原子又可被3mol Cl2完全取代,则此气态烃可能是( )| A. | CH3C≡CCH3 | B. | CH2=CH2 | C. | CH≡CCH3 | D. | CH2=CHCH3 |
分析 气态烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol氯代烃中含有3molH原子,则0.5mol烃中含有2molH原子,即1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,以此解答该题.
解答 解:烃0.5mol能与1molHCl加成,说明烃中含有1个C≡C键或2个C=C键,加成后产物分子上的氢原子又可被3molCl2完全取代,说明0.5mol氯代烃中含有3molH原子,则0.5mol烃中含有2molH原子,即1mol烃含有含有4molH,并含有1个C≡C键或2个C=C键,符合要求的只有CH≡CCH3,故选C.
点评 本题主要考查有机物的结构和性质,题目难度不大,注意有机物的加成和取代反应特征,Cl取代H的位置,原子个数不变.

练习册系列答案
相关题目
13.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 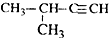 2-甲基-3-丁炔 | B. | 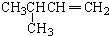 3-甲基丁烯 | C. | 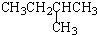 2-甲基丁烷 | D. | 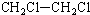 二氯乙烷 |
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 28g乙烯所含共用电子对数目为4NA | |
| C. | 1mol甲基(-CH3)所含的电子总数为7NA | |
| D. | 现有乙烯.丙烯.丁烯的混合气体共14g,其原子数为3NA |
11.某温度下,向pH=6的纯水中加入一定量的氢氯酸,保持温度不变,测得溶液的pH=3,对于该溶液,下列叙述中不正确的是( )
| A. | pH=6的纯水呈中性 | |
| B. | 该溶液的浓度c(HCl)=0.001 mol•L-1 | |
| C. | 该溶液中水电离产生的c(H+)=10-9 mol•L-1 | |
| D. | 该温度下,加入等体积的pH=11NaOH溶液,即可恰好完全中和 |
18.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基所含有的电子数是10NA个 | |
| B. | 1mol苯乙烯中含有的碳、碳双键数为4NA个 | |
| C. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
8.下列比较错误的是( )
| A. | 金属性:Na>Mg>Al | B. | 非金属性:Cl>S>P>Si | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 酸性:HClO>H2SO3>H3PO4>H4SiO4 |
15.酚酞是中学阶段常用的酸碱指示剂,结构简式如图所示:下列关于酚酞的说法错误的是( )
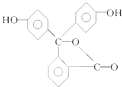

| A. | 酚酞与水可以形成氢键 | |
| B. | 酚酞的分子式为C20H14O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在一定条件下能够发生加成反应 |
12.下列有关叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温材料的元素 | |
| C. | 在金属元素区域中可以寻找制备新型农药材料的元素 | |
| D. | 23592U可用作核反应堆的燃料,21H与31H可用作制造氢弹的原料 |
 A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A原子外围电子排布为ns2np2,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空: