题目内容
常温时:在20ml由HNO3和H2SO4组成的混合溶液中,逐滴加入4mol/L的Ba(OH)2
溶液,当加入15mL时沉淀量达到最大,当加入20mL时溶液的pH=7,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
溶液,当加入15mL时沉淀量达到最大,当加入20mL时溶液的pH=7,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
考点:化学方程式的有关计算,pH的简单计算
专题:计算题
分析:15mL时沉淀量达到最大,说明硫酸根离子恰好完全沉淀;当加入20mL时溶液的pH=7,说明此时氢氧化钡提供的氢氧根离子的物质的量与混合酸提供的氢离子的物质的量相等,由此分析解题.
解答:
解:15mL时沉淀量达到最大,即n(H2SO4)=n[Ba(OH)2],所以20mL×c(H2SO4)=15mL×4mol/L,所以c(H2SO4)=3mol/L;当加入20mL时溶液的pH=7,n(HNO3)+2n(H2SO4)=2n[Ba(OH)2],由此可得:n(HNO3)+2×20mL×3mol/L×10-3=2×4mol/L×10-3×20mL,解之得:n(HNO3)=0.04mol,所以c(HNO3)=
=2mol/L,
答:原溶液中HNO3和H2SO4的物质的量浓度分别是3mol/L和2mol/L.
| 0.04mol |
| 0.02L |
答:原溶液中HNO3和H2SO4的物质的量浓度分别是3mol/L和2mol/L.
点评:本题考查混合物计算,抓住沉淀最大量和溶液呈中性的实质进行计算,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有一分子式为C8H14N2O5的二肽,经水解得丙氨酸和氨基酸X,则X分子组成可能是( )
| A、C3H7NO3 |
| B、C5H9NO4 |
| C、C5H11NO5 |
| D、C5H7NO4 |
恒温条件下,某固定体积的密闭容器中发生可逆反应A(气)+B(气)?C(气),可说明该反应达到平衡状态的是( )
| A、A、B、C的分子数之比为1:3:2 |
| B、单位时间内生成n mol A,同时生成3n mol B |
| C、容器中气体的总压不再发生变化 |
| D、反应停止了 |
下列说不正确的是( )
| A、反应热指的是反应过程中放出的热量 |
| B、热化学方程式的化学计量数可表示分子的个数 |
| C、在热化学方程式中无论反应物还是生成物都必须标明聚集状态 |
| D、所有的化学反应均伴随能量变化 |

 (R为烃基),则有机物A的结构
(R为烃基),则有机物A的结构 ,试写出苧烯的同分异构体(用
,试写出苧烯的同分异构体(用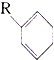 表示)与
表示)与 反应的化学方程式:
反应的化学方程式: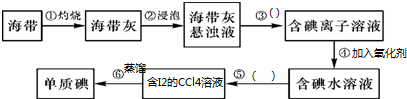
 蒸馏是实验室制备蒸馏水的常用方法.
蒸馏是实验室制备蒸馏水的常用方法.