题目内容
16.下列离子方程式书写正确的是( )| A. | 淀粉-KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- | |
| B. | Fe2O3溶于氢碘酸溶液:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-═H2O+NH3↑ | |
| D. | 二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O═4H++2Br-+SO42- |
分析 A.酸性条件下,反应生成物中不能有氢氧根离子;
B.三价铁具有氧化性能氧化碘离子;
C.碳酸氢铵与氢氧化钠溶液反应生成碳酸钠和一水合氨;
D.二氧化硫与溴水反应生成HBr和硫酸.
解答 解:A.粉KI试纸经硫酸酸化后在空气中变蓝,反应生成碘和水,离子方程式:4I-+O2+4H+═2I2+2H2O,故A错误;
B.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2,故B错误;
C.碳酸氢铵与足量NaOH溶液混合反应生成碳酸钠和一水合氨,反应的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故C错误;
D.二氧化硫与溴水反应生成HBr和硫酸,反应的离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42-,故D正确.
故选D.
点评 本题考查了离子方程式书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质是解题关键,注意化学式拆分,注意离子反应遵循客观事实、遵循原子个数、电荷守恒规律.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
4. 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
 已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )
已知X+、Y-、Z、H2O均为10电子结构的微粒,Z可使湿润的红色石蕊试纸变蓝,它们在一定条件下可发生如图转化.下列说法正确的是( )| A. | H2O的电子式为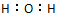 | B. | Z的沸点低于H2O的沸点 | ||
| C. | X+含有离子键 | D. | 含有Y-的溶液一定呈碱性 |
5. 某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
 某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )
某有机物的结构简式图,取Na、NaOH、H2分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、H2三种物质的物质的量之比为( )| A. | 3:2:5 | B. | 3:3:4 | C. | 3:2:4 | D. | 1:1:1 |
4.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$\stackrel{H_{2}}{→}$Si | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(g)}{→}$NH4Cl(s) | |
| D. | 由NaCl制漂粉精:NaCl(aq)$\stackrel{点解}{→}$Cl2$\stackrel{澄清石灰水}{→}$漂粉精 |
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时K+向正极方向移动 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有2 mol K2 FeO4被还原 | |
| D. | 放电时正极附近溶液的碱性增强 |
1.下列化学用语表示错误的是( )
| A. | F-的结构示意图: | |
| B. | NaCl的电子式: | |
| C. | 8个中子的碳原子的核素符号:${\;}_{6}^{14}$C | |
| D. | CO2的结构式:O=C=O |
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| B. | 32 g S8单质(S8分子结构如图)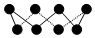 中含有的S-S键个数为8NA 中含有的S-S键个数为8NA | |
| C. | 17g的氢氧根离子中含有的电子数为9NA | |
| D. | 常温下,4.6gNa和足量的O2完全反应失去电子数为0.2NA |
5.向a mL 18mol•L-1的浓硫酸中加入足量铜片,并加热,被还原的H2SO4的物质的量和起酸性作用的H2SO4的物质的量分别为( )
| A. | 大于9a×10-3mol,小于18a×10-3mol | B. | 都等于9a×10-3mol | ||
| C. | 都等于18a×10-3mol | D. | 都小于9a×10-3mol |
 :请写出X的分子式C12H10.
:请写出X的分子式C12H10.