题目内容
15.某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如图实验装置.
(1)如上图连接好装置.实验前应进行检查装置的气密性操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性).
猜想1:空气与SO2进入H2O中,氧气把二氧化硫氧化生成了H2SO4;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3-氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验.
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想.请在表格中写出实验步骤以及预期现象和结论.限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、Fe(NO3)3溶液
| 实验步骤 | 预期现象和结论 |
分析 (1)组装完仪器需检验装置的气密性;
(2)二氧化硫具有还原性,可被氧化剂氧化;
(4)Fe3+具有氧化性,可与二氧化硫发生氧化还原反应;
(5)丙同学观点是在SO2与NO3-反应,则可用NaNO3溶液、BaCl2溶液代替BaCl2溶液、Fe(NO3)3溶液
即可.
解答 解:(1)组装完仪器需检验装置的气密性,
故答案为:检查装置的气密性;
(2)猜想2:SO2被Fe3+氧化了;猜想3:SO2被NO3-氧化了,装置中含有的氧化剂还有氧气,故可能被氧气氧化,
故答案为:空气与SO2进入H2O中,氧气把二氧化硫氧化生成了H2SO4;
(4)按观点2,装置B中反应的离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+,
故答案为:SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+;
(5)丙同学观点是在SO2与NO3-反应,则可用NaNO3溶液、BaCl2溶液代替BaCl2溶液、Fe(NO3)3溶液即可,具体操作为:将装置C中的溶液换为NaNO3 和BaCl2的混合溶液,反应一段时间后,若C中出现白色沉淀,则证明猜想3正确,
故答案为:
| 实验步骤 | 预期现象和结论 |
| 将装置C中的溶液换为NaNO3 和BaCl2的混合溶液, 然后打开分液漏斗活塞进行反应 | 反应一段时间后,若C中出现白色沉淀,则证明猜想3正确 |
点评 本题考查物质的性质实验探究,题目难度中等,注意把握物质的性质,为解答该题的关键,学习中注意相关知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
3.下列化学用语表达正确的是( )
| A. | 磷酸的电离:H3PO4?3H++PO43- | |
| B. | 甲烷的燃烧为-890.3KJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3KJ•mol-1 | |
| C. | 实验室制取氢氧化铁胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用双氧水处理含NaCN的碱性废水:2CN-+5H2O2+2OH-═2CO32-+N2↑+6H2O |
3.把Al和Fe3O4粉配成铝热剂,分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,后一份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成气体的物质的量之比为( )
| A. | 1:3 | B. | 9:8 | C. | 3:4 | D. | 4:3 |
10.以下各组离子中,在pH=13.0的溶液中能大量共存的是( )
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
4.在2014年国家科学技术奖励大会上,甲醇制取低碳烯烃技术(DMTO)获国家技术发明奖一等奖.DMTO主要包括煤的气化、液化、烯烃化三个阶段.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
①a<0(填“>”、“<”、“=”),c与a、b之间的定量关系为c=a+b.
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).
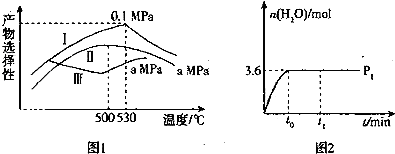
①尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.
(1)煤的气化:用化学方程式表示出煤的气化的主要反应C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2:
(2)煤的液化:下表中有些反应是煤液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |
②K3=2.5,若反应③是在容积为2L的密闭容器巾进行(500℃)的,测得某一时刻体系内H2、CO2、CH3OH、H2O物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率>(填“>”、“<”、“=”) CH3OH的消耗速率.
(3)烯烃化阶段:如图l是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比,图中I、Ⅱ表示乙烯,Ⅲ表示丙烯).

①尽可能多地获得乙烯,控制的生产条件为530℃,0.1Mpa.
②一定温度下某密闭容器中存在反应,2CH3OH(g)?CH2=CH2(g)+2H2O(g)△H>0.在压强为P1时,产物水的物质的量与时间的关系如图2所示,若t0 时刻,测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为85.7%(保留三位有效数字),若在t1 时刻将容器容积快速扩大到原来的2倍,请在图中绘制出此变化发生后至反应达到新平衡时水的物质的量与时间的关系图.
5.用化学方法除去下列物质中的杂质(括号内为杂质),填写所加试剂和有关离子反应方程式.
| 试剂 | 离子反应方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
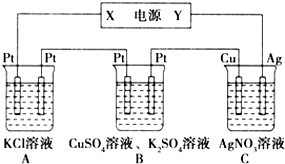 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答: