题目内容
14. 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.(1)画出装置图(在图中标出电极材料、电解质溶液)
(2)写出电极反应方程式:负极:Cu-2e-=Cu2+,正极:2Fe3++2e-=2Fe2+
分析 该反应中Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,发生氧化反应的金属Cu作负极、不如Cu活泼的金属或导电的非金属作正极,FeCl3为电解质,据此设计原电池.
解答 解:(1)根据电池反应式知,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以Cu作负极,不如铜活泼的金属或导电的非金属作正极,如C,FeCl3溶液为电解质溶液,其装置图为 ,故答案为:
,故答案为: ;
;
(2)由方程式可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+.
点评 本题考查了原电池设计,这些新课标要求学生需要掌握的内容,正确判断原电池正负极材料、电解质溶液是设计原电池难点,一般来说,还原剂作负极,不如负极活泼的金属或非金属导体作正极,氧化剂的溶液作电解质溶液.

练习册系列答案
相关题目
4.温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤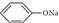 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
 ⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )
⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是( )| A. | ③①④②⑥⑤ | B. | ①③⑥④②⑤ | C. | ③②①⑥④⑤ | D. | ⑤⑥②④①③ |
2.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如图所示.A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素.下列说法错误的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | A、D、E均可形成两种常见氧化物 |
9.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,78 g 固体Na2O2中,含有的阴阳离子总数为4 NA | |
| B. | 标准状况下,4.48L HF分子中含0.2NA个H-F键 | |
| C. | 常温常压下,8gO2含有8NA个电子 | |
| D. | 4℃时,20 g 2H216O中含有共用电子对数为2 NA |
19.某元素X的气态氢化物化学式为H2X,则X的最高价氧化物对应的水化物的化学式为( )
| A. | H2XO3 | B. | HXO3 | C. | H3XO4 | D. | H2XO4 |
6.下列性质的递变规律不正确的是( )
| A. | NaOH、KOH、CsOH碱性依次增强 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Al、Mg、Na的原子半径依次减小 | |
| D. | Li、Na、K、Rb、Cs原子半径依次增大 |
3.已知:
则乙苯催化脱氢制苯乙烯: 的反应热为( )
的反应热为( )
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412 | 348 | 612 | 436 |
 的反应热为( )
的反应热为( )| A. | +124 kJ/mol | B. | +246 kJ/mol | C. | +368 kJ/mol | D. | +429 kJ/mol |
4.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.12mol/L,则下列判断不正确的是( )
| A. | 无法确定c1:c2的值 | B. | 平衡时,Y和Z的生成速率之比为3:2 | ||
| C. | 0.28mol/L<c1+c2+c3<0.56mol/L | D. | c1的取值范围为0<c1<0.14mol/L |
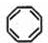 互为同分异构体且属于芳香烃的分子的结构简式:
互为同分异构体且属于芳香烃的分子的结构简式: ;
;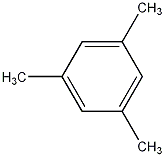 、
、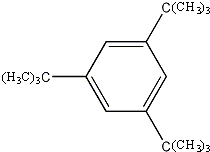 .
.