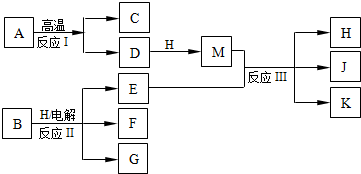
题目内容
5.NH3可用于制造硝酸、纯碱等,还可用于烟气脱硝.(1)NH3催化氧化可制备硝酸.
①NH3氧化时发生如下反应:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1269.02kJ•mol-1
则4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H3=-1811.63kJ•mol-1.
②NO被O2氧化为NO2.其他条件不变时,NO的转化率[α(NO)]与温度、压强的关系如1图所示.则p1>p2(填“>”“<”或“=”);平衡常数的表达式K=$\frac{c(NO{\;}_{2}){\;}^{2}}{c(NO){\;}^{2}c(O{\;}_{2})}$;温度高于800℃时,α(NO)几乎为0的原因是NO2几乎完全分解

(2)利用反应NO2+NH3-→N2+H2O(未配平)消除NO2的简易装置如图2所示.电极b的电极反应式为2NO2+8e-+4H2O═8OH-+N2;消耗标准状况下4.48L NH3时,被消除的NO2的物质的量为0.15mol.
(3)合成氨的原料气需脱硫处理.一种脱硫方法是:先用Na2CO3溶液吸收H2S生成NaHS;NaHS再与NaVO3反应生成S、Na2V4O9和物质X.NaHS与NaVO3反应的化学方程式为2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
分析 (1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$,由此分析解答;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;平衡常数的表达式应为生成物浓度的幂次方之积比上反应物浓度的幂次方之积;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(2)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2进行计算;
(3)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$=1811.63 kJ•mol-1,故答案为:=-1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;NO被O2氧化为NO2,方程式为:2NO+O2?2NO2,则平衡常数的表达式K=$\frac{c(NO{\;}_{2}){\;}^{2}}{c(NO){\;}^{2}c(O{\;}_{2})}$;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;故答案为:>;$\frac{c(NO{\;}_{2}){\;}^{2}}{c(NO){\;}^{2}c(O{\;}_{2})}$;NO2几乎完全分解;
(2)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为$\frac{3}{4}$=0.15mol,故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(3)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,故答案为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
点评 本题考查盖斯定律的应用、依据图象分析平衡移动的原因、及电极反应式书写,考查范围广,易错题为(2)题,会根据化合价的变化确定NO2的电极,然后书写电极反应式.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 少量金属钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 60 mL 1 mol/L纯碱溶液与20 mL 2 mol/L胆矾溶液混合(无气体放出):3CO32-+2Cu2++2H2O=2HCO3-+Cu2(OH)2CO3↓ | |
| C. | 向H2O中投入少量Na218O2固体:2H2O+2Na218O2=4Na++418OH-+O2↑ | |
| D. | 向碳酸氢钙溶液中加入少量KOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| A. |  | B. |  | C. |  | D. |  |
| A. | H+、Ca2+、Cl-、CO32- | B. | Cl-、ClO-、K+、H+ | ||
| C. | Na+、Fe3+、SO42-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
 如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )
如图是镁一空气燃料电池工作原理示惫图,电池总反应为:2Mg+O2+2H2O=2Mg(OH)2.下列有关该电池的说法正确的是( )| A. | a极为负极,发生还原反应 | |
| B. | b电极上电极反应:O2+2H2O+4e-=4OH- | |
| C. | 工作时电子由b极经外电路流向a极 | |
| D. | 该装置实现了电能转化成化学能 |
| A. | 将钢片插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| B. | 稀硫酸与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 向Na2SiO3溶液中滴加醋酸:SiO32-+2H+=H2SiO3↓ |
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(2)为检验制得的硫酸亚铁晶体中是否含有Fe3+,可选用的试剂为AC;
A.KSCN溶液B.稀硫酸C.淀粉-KI溶液D.KMnO4溶液
(3)通入H2S气体至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化;用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀;
(4)为研究硫酸亚铁晶体的热分解,某兴趣小组同学称取ag硫酸亚铁晶体样品,按图1装置进行高温加热,使其完全分解(硫酸亚铁晶体在高温条件下回分解为三种化合物和一种单质,该单质能使带火星的木条复燃),对所得产物进行探究,并通过称量装置B的质量测出x的值.
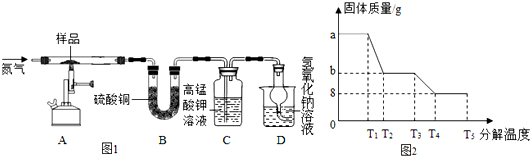
①装置B中午睡硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中含有二氧化硫;
②实验中要持续通入氮气,否则测出的x会偏小(填“偏大”、“偏小”或“不变”);
③硫酸亚铁晶体完全分解后装置A中固体呈红棕色,将其加入足量稀盐酸中,固体全部溶解,得黄色溶液;
④某研究所利用SDTQ600热分析仪对硫酸亚铁晶体进行热分解,获得相关数据,绘制成的固体质量与分解温度的关系图如图2,根据图中有关数据,可计算出x为7.
| A. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| B. | 硫化钠和硫酸亚铁固体长期暴露在空气中变质 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | H2O2溶液中加入少量MnO2或FeCl3溶液都能增大反应速率 |