题目内容
4.铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O$?_{充电}^{放电}$Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )| A. | 电池的电解质溶液为碱性溶液,阳离子向正极移动 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
分析 根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O.
解答 解:A.反应后产物有氢氧化物,可得电解液为碱性溶液,放电时阳离子向正极移动,故A正确;
B.根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,负极反应为:Fe+2OH--2e-=Fe(OH)2,故B正确;
C.充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,因此电池充电过程中阴极附近溶液的pH会升高,故C错误;
D.充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故D正确;
故选C.
点评 本题考查二次电池的工作原理,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应.

练习册系列答案
相关题目
14.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  图除去CO2中的HCl | |
| B. |  图装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  图所示装置制取并收集干燥纯净的NH3 | |
| D. | 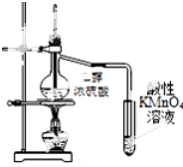 图证明CH3CH2OH发生消去反应生成了乙烯 |
15.下列反应可用离子方程式“H++OH-=H2O”表示的是( )
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
12.下列做法不会对人体健康造成危害的是( )
| A. | 加三聚氰胺提高牛奶的含氮量 | |
| B. | 用苏丹红(色素)作食品着色剂 | |
| C. | 加小苏打(NaHCO3)作馒头的膨松剂 | |
| D. | 用含有甲醇(CH3OH)的工业酒精兑制饮用白酒 |
16.下列措施肯定使化学反应速率增大的是( )
| A. | 升高温度 | B. | 增加压强 | C. | 增大反应物的量 | D. | 使用催化剂 |
8.从理论上讲,一切自发的氧化还原反应均可设计成原电池,下列不正确的是( )
| A. | 非自发的氧化还原反应不可以设计成原电池 | |
| B. | 将反应 3Cu+8HNO3═3Cu(NO3)2+2NO+4H2O 设计成原电池,其正极反应为:2NO3-+6e-+8H+═2NO+4H2O | |
| C. | 铅蓄电池工作时,正极、负极质量均增加 | |
| D. | 氢氧燃料电池耗H20.1mol时,电路中流经的电子数为0.1NA |
9.配制500mL0.1mol/L的NaOH溶液,下列操作会使溶液的物质的量浓度偏大的是( )
| A. | 定容时,仰视刻度线 | B. | 称量用了生锈的砝码 | ||
| C. | 未洗涤溶解NaOH的烧杯 | D. | 容量瓶未经过干燥即用来配制溶液 |
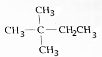
 (2)
(2)
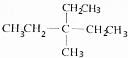 (4)
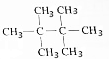
(4)
 2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.