题目内容
甲、乙两个烧杯中分别盛有100mL 4.0mol/L的盐酸和100mL 4.0mol/L NaOH溶液,向两个烧杯中均加入5.4g铝粉,在相同状况下产生气体的体积比为( )
| A、1:1 | B、2:3 |
| C、3:2 | D、3:1 |
考点:铝的化学性质,化学方程式的有关计算
专题:计算题
分析:发生2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,n(Al)=
=0.2mol,n(HCl)=n(NaOH)=0.1L×4.0mol/L=0.4mol,以此计算.
| 5.4g |
| 27g/mol |
解答:
解:n(Al)=
=0.2mol,n(HCl)=n(NaOH)=0.1L×4.0mol/L=0.4mol,Al与盐酸反应时,盐酸不足,与NaOH反应时Al不足,则
2Al+6HCl═2AlCl3+3H2↑
0.4mol 0.2mol
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
0.2mol 0.3mol
生成气体的体积之比等于物质的量之比,为0.2mol:0.3mol=2:3,
故选B.
| 5.4g |
| 27g/mol |
2Al+6HCl═2AlCl3+3H2↑
0.4mol 0.2mol
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
0.2mol 0.3mol
生成气体的体积之比等于物质的量之比,为0.2mol:0.3mol=2:3,
故选B.
点评:本题考查Al的化学性质及化学反应的计算,为高频考点,把握发生的反应及反应中物质的量的关系判断过量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(S)的影响,甲的压强比乙的压强大 |
| C、图3表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
| D、图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
下列除去杂质的方法中,错误的是( )
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 稀硫酸 | 铜 | 过滤 |
| B | CaSO4溶液 | 稀硫酸 | 过量CaCO3、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | 二氧化碳 | 一氧化碳 | 点燃 |
| A、A | B、B | C、C | D、D |
下列物质中,不属于卤代烃的是( )
| A、氯乙烯 | B、溴苯 |
| C、四氯化碳 | D、硝基苯 |
下列不能由单质直接化合而成的物质是( )
| A、FeCl2 |
| B、CuCl2 |
| C、AlCl3 |
| D、NaCl |
0.2mol有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g.0.1mol该有机物恰好与4.6g金属钠完全反应.下列关于该有机物的说法不正确的是( )
| A、该化合物的相对分子质量是62 |
| B、该化合物的化学式为C2H6O2 |
| C、1 mol该化合物能与2 mol O2发生催化氧化反应 |
| D、1 mol该有机物最多能与2 mol Na反应 |
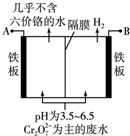 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )| A、A接电源负极 |
| B、阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2mol Cr2O72-被还原 |
下列试剂的保存或使用正确的是( )
| A、实验室的氯水需要保存在棕色试剂瓶中 |
| B、漂白粉比氯水稳定,可露置在空气中 |
| C、称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码 |
| D、金属钠可保存在煤油、四氯化碳等有机溶剂中 |