题目内容
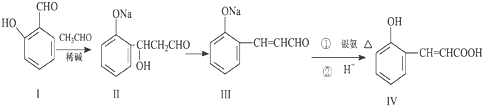
如表是几种电解质的电离常数(25℃)
(1)电解质的强弱顺序为 (用化学式表示,下同).
(2)物质的量浓度相同的上述溶液,氢离子浓度最小的是 ,溶质分子浓度最小的是 .
(3)25℃时,在0.5L 0.2mol?L-1的HA溶液中,有0.01mol的HA电离成离子.该温度下HA的电离常数K= .
| 电解质 | a.HF | b.HNO2 | c.HCN | d.NH3?H20 | e.H2S |
| 电离平衡常数 | 7.2×10-4 | 4.6×10-10 | 4.9×10-10 | 1.8×10-5 | k1=9.1×10-8 k2=1.1×10-12 |
(2)物质的量浓度相同的上述溶液,氢离子浓度最小的是
(3)25℃时,在0.5L 0.2mol?L-1的HA溶液中,有0.01mol的HA电离成离子.该温度下HA的电离常数K=
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)电离常数越大,电解质越易电离;
(2)氢离子浓度最小的溶液碱性最强;溶质分子浓度最小的电离程度最大;
(3)根据HA电离出来的离子的量求出其浓度,再根据电离平衡常数K=
计算.
(2)氢离子浓度最小的溶液碱性最强;溶质分子浓度最小的电离程度最大;
(3)根据HA电离出来的离子的量求出其浓度,再根据电离平衡常数K=
| C(H+).C(A-) |
| C(HA) |
解答:
解:(1)①电离常数越大,电解质越易电离,则电解质的强弱顺序为HF>HHNO2>NH3?H20>H2S>HCN>HS-,
故答案为:HF>HNO2>NH3?H20>H2S>HCN>HS-;
(2)氢离子浓度最小的溶液碱性最强,氨水符合,溶质分子浓度最小的电离程度最大,应为HF,故答案为:NH3?H20;HF;
(3)在0.5L0.2mol.L-1的HA溶液中,有0.01mol的HA电离成离子,即n(A-)=n(H+)=
=0.02mol.L-1,则K=
=
≈2.22×10-3,
故答案为:2.22×10-3.
故答案为:HF>HNO2>NH3?H20>H2S>HCN>HS-;
(2)氢离子浓度最小的溶液碱性最强,氨水符合,溶质分子浓度最小的电离程度最大,应为HF,故答案为:NH3?H20;HF;
(3)在0.5L0.2mol.L-1的HA溶液中,有0.01mol的HA电离成离子,即n(A-)=n(H+)=
| 0.01mol |
| 0.5L |
| C(H+).C(A-) |
| C(HA) |
| 0.02×0.02 |
| 0.2-0.02 |
故答案为:2.22×10-3.
点评:本题考查电解质的电离、电离常数的计算,为高频考点,侧重于学生的分析能力以及基础知识的应用能力的考查,题目难度中等.

练习册系列答案
相关题目
氯化钠和水都是稳定的化合物,使它们发生分解十分困难,只有在何条件下才能使食盐水电解( )
| A、加热情况下 |
| B、加压条件下 |
| C、通直流电情况下 |
| D、常温常压下 |
已知2X+O2→2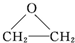 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )
 是原子利用率为100%的转化.下列对X的推断中不正确的是( )
是原子利用率为100%的转化.下列对X的推断中不正确的是( )| A、可使酸性KMnO4溶液褪色 |
| B、可使溴水褪色 |
| C、一定条件下,可用H2除去乙烷中的X |
| D、与丙烯互为同系物 |
下列有关说法不正确的是 ( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)低温下能自发进行,说明该反应的△H<0 |
| B、常温下,将醋酸稀溶液加水稀释,溶液中c(H+)/c(CH3COOH)增大 |
| C、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| D、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
将4.34gNa、Na2O、Na2O2的混合物与足量水反应,生成的气体在标准状况下得到0.672L混合气体.该混合气体通过电火花产生器,恰好完全反应,则混合物中Na、Na2O和Na2O2的物质的量之比为( )
| A、1:1:1 |
| B、1:1:2 |
| C、1:2:1 |
| D、4:3:2 |
某无色混合气体,可能含有CO、H2、SO2、Cl2、HCl中的一种或几种,把它们通过NaOH溶液,无明显现象;再通过红热的CuO粉末,粉末变成红色;最后通往AgNO3溶液中,无沉淀生成,原混合气体中( )
| A、肯定没有Cl2和HCl |
| B、CO和H2中至少有一种 |
| C、不能确定有无HCl、SO2 |
| D、肯定有SO2 |