题目内容
【题目】对反应:aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是
cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是
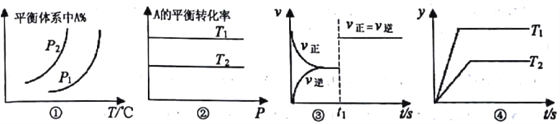
A. 图①中,若P1>P2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则△H<0 且a+b=c+d
C. 图③中t1时刻改变的条件一定是使用了催化剂
D. 图④中,若△H<0,则纵坐标不可能表示的是反应物的转化率
【答案】C
【解析】A. 由分析图①可知,温度升高,A%增大,说明平衡逆移动,则正反应为放热反应,若P1>P2,P1时A%低于P2,压强增大,平衡正向移动,则反应前气体分子数小于反应后气体分子数,△S<0,则该反应在较低温度下有利于自发进行,A正确;B. 图②中,压强增大,A的转化率不变,平衡不移动,则a+b=c+d,若T2>T1,A的转化率降低,平衡逆移动,则正反应为放热反应,△H<0,B正确;C. 图③中t1时刻改变的条件可能是使用了催化剂,也可能是增大压强(当a+b=c+d时),C错误;D. 图④中,T1>T2,若△H<0,升高温度平衡逆向移动,转化率减小,则纵坐标不可能表示的是反应物的转化率,D正确。答案选C。

练习册系列答案
相关题目