题目内容
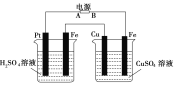
【题目】按下图装置进行实验,并回答下列问题:
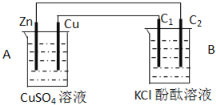
(1)判断装置的名称:A池为_________,B池为___________。
(2)铜极为______极,电极反应式为_________,石墨棒C1为___极,电极反应式为______________________,石墨棒C2附近发生的实验现象为___________________。
(3)当C2极析出224mL气体(标准状态时),锌的质量变化(增加或减少)_____g,CuSO4溶液的质量变化了(增加或减少了)______g。
【答案】 原电池 电解池 正极 Cu2++2e-=Cu 阳 2Cl--2e-=Cl2↑ 碳棒附近溶液变红且产生气体 减少0.65 增加0.01
【解析】
(1)锌能和硫酸铜发生置换反应,锌、铜和硫酸铜溶液构成原电池,因此A是原电池,则B是电解池。
(2)锌的金属性强于铜,则锌是负极,铜是正极,溶液中的铜离子得到电子,电极反应式是Cu2++2e-=Cu。石墨棒C1与电源的正极相连,为阳极,发生失去电子的氧化反应,即溶液中的氯离子放电,电极反应式为2Cl--2e-=Cl2↑;石墨棒C2和电源的负极相连,做阴极,溶液中的氢离子放电,同时破坏溶液中水的电离平衡,使阴极周围溶液显碱性,所以C2附近发生的实验现象为碳棒附近溶液变红且产生气体。
(3)224mL气体是氢气,物质的量是0.01mol,则转移0.02mol电子,所以根据电子的得失守恒可知消耗锌的物质的量是0.02mol÷2=0.01mol,质量是0.65g,即锌的质量减少0.65g。由于正极析出铜的质量是0.64g,所以溶液质量增加0.65g-0.64g=0.01g。

【题目】燃煤的烟气中含有SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
(1)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是______(填字母序号)。
a.石灰乳b.CaCl2溶液
(2)某工厂利用含SO2的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用SO2处理含铬废水时,利用了SO2的______性。
②吸收塔中发生反应的离子方程式为____________________________________。
(3)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Cr2O72- | Cr3+ | H + | Na + | SO42- |
浓度(mol/L) | a | 0.2×10-6 | 1.2×10-6 | 6.8×10-6 | 3.0×10-6 |
则a= ______。