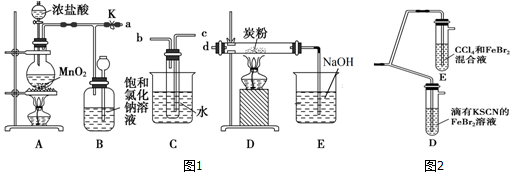
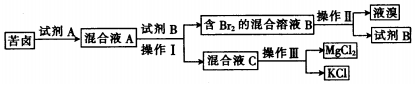
题目内容
20.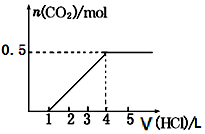 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A. | 通入的CO2气体为11.2 L | B. | A溶液中n(NaHCO3)=2n(Na2CO3) | ||
| C. | A溶液中既含NaOH,又含Na2CO3 | D. | A溶液中一定只有Na2CO3 |
分析 若溶质只有Na2CO3,加入盐酸开始发生Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,前后两阶段消耗盐酸体积之比为1:1,而实际消耗盐酸体积为1:(4-1)=1:3,故溶质为Na2CO3、NaHCO3,以此来解答.
解答 解:由图可知,开始不生成气体,后来生成气体,且耗盐酸体积为1:(4-1)=1:3,故溶质为Na2CO3、NaHCO3,由NaHCO3+HCl=NaCl+CO2↑+H2O可知,n(CO2)=0.5mol,Vm未知,不能计算其体积,该反应消耗盐酸为0.5mol,n(NaHCO3)=0.5mol,
由Na2CO3+HCl=NaHCO3+NaCl可知,n(HCl)=n(Na2CO3)=$\frac{0.5mol}{3}$,
则原NaHCO3为0.5mol-$\frac{0.5mol}{3}$=$\frac{1.0mol}{3}$,
即A溶液中n(NaHCO3)=2n(Na2CO3),
故选B.
点评 本题考查化学反应的计算,为高频考点,把握图中气体的生成、反应与图象的对应关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
17.欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
| 制备气体 | X(除杂试剂) | Y (检验试剂) | 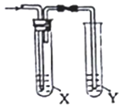 | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
| B | 电石与NaCl水溶液 | H2O | Br2的CCl4溶液 | |
| C | C2H5OH与浓硫酸 加热至170℃ | 饱和NaHSO3 溶液 | K2Cr2O7酸性溶液 | |
| D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
9.侯氏制碱法的原理为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,实验室模拟该过程包括制备NH3、制取NaHCO3、分离及灼烧NaHCO3四个步骤,下列图示装置能达到实验目的是( )
| A. | 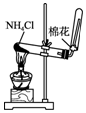 制备氨气 | B. | 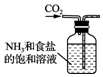 制取NaHCO3 | C. | 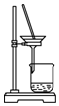 分离NaHCO3 | D. | 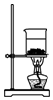 灼烧NaHCO3 |
10.我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2═H2O2+S,已知甲池中发生的反应:下列说法正确的是( )


| A. | 甲池中碳棒上发生的电极反应为AQ+2H+-2e-═H2AQ | |
| B. | 乙池溶液中发生的反应为H2S+I3-═3I-+S+2H+ | |
| C. | 该装置中电能转化为光能 | |
| D. | H+从甲池移向乙池 |
 某化学实验小组拟用如图装置进行钠与氧气反应的实验.
某化学实验小组拟用如图装置进行钠与氧气反应的实验.