题目内容
4.SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02mg/L.下列措施中能够减少SO2 排放量的是( )①用天然气代替煤炭做民用燃料 ②提高热能利用率 ③硫酸厂采用更好的催化剂使SO2氧化成SO3 ④使用CS2萃取煤炭中的硫 ⑤燃煤中加入石灰后再使用.
| A. | ①②⑤ | B. | ①③⑤ | C. | ①③④ | D. | ③④⑤ |
分析 ①煤炭中含有一定量的硫,用煤炭作民用燃料会向大气中排放出较多的SO2,改用天然气作民用燃料可减少SO2的排放量;
②提高热能利用率,这样可以降低煤的使用量,从而降低SO2的排放;
③使用催化剂无法提高二氧化硫的转化率;
④煤中的硫不一定都是硫单质,且现实操作复杂,二硫化碳造价高,增加了成本;
⑤燃煤中加石灰脱硫是工业上常用的比较有效的方法,氧化钙、硫、氧气等物质反应能生成硫酸钙,可以减少燃煤的过程中的SO2排放量.
解答 解:①民用煤是含有S元素的,天然气不含S,所以能减少SO2排放,故①正确;
②提高热能利用率,这样可以降低煤的使用量,从而降低SO2的排放,但此方法本身并不能降低SO2,而是通过降低煤的使用量减少SO2排放量,故②正确;
③催化剂只能提高反应速率,无法提高二氧化硫的转化率,故③错误;
④由于生产CS2的成本高,操作复杂,现实中无法实现使用CS2萃取大量煤炭中的硫,该操作方法不可行,故④错误;
⑤燃煤中加石灰脱硫,氧化钙、硫、氧气等物质进行反应,化学方程式为:2CaO+2S+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4,用这种方法可以减少燃煤的过程中的SO2排放量,故⑤正确;
故选A.
点评 本题考查了二氧化硫的污染及治理措施,题目难度不大,注意掌握二氧化硫的化学性质及对大气的污染,明确能够减少SO2排放量的措施.

练习册系列答案
相关题目
15.下列有关反应中,属于吸热反应的是( )
| A. | 碳酸钙受热分解 | B. | 天然气的燃烧 | ||
| C. | 铝粉与稀盐酸反应 | D. | 生石灰变成熟石灰 |
12.常温下,下列溶液中可能大量共存的离子组是( )
| A. | 能使甲基橙变红的溶液中:Na+、Fe2+、SO42-、NO3- | |
| B. | 某无色溶液中:Mg2+、ClO-、SO42-、Fe2+ | |
| C. | 能使KSCN变红的溶液中:NH4+、Na+、SiO32-、HCO3- | |
| D. | 水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
19.以下现象与电化学腐蚀无关的是( )
| A. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| B. | 生铁比纯铁容易腐蚀 | |
| C. | 铁质器件附有的铜质配件,在接触处容易生铁锈 | |
| D. | 银质物品久置表面变暗 |
13.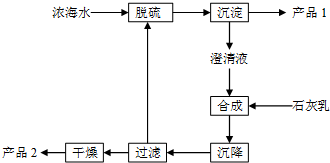 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是 _.
_.
②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 _.
_.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl_.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
14.下列叙述中正确的是( )
| A. | 电子的能量越低,运动区域离原子核越远 | |
| B. | 核外电子的分层排布即是核外电子的分层运动 | |
| C. | 稀有气体元素原子的最外层都排有8个电子 | |
| D. | 当M层是最外层时,最多可排18个电子 |

 按要求完成下列问题:
按要求完成下列问题: