题目内容
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
D
解析试题分析:A、金属性越强,第一电离能越小,但由于Mg元素的3s电子处于全充满状态,稳定性强于Al
元素的,因此镁的第一电离能大于铝元素的第一电离能,A不正确;B、F是第ⅦA族元素,但F是最活泼的非金属,没有正价,B不正确;C、溶液的酸碱性只与溶液中氢离子浓度和OH-浓度的相对大小有关系。由于不能确定溶液的温度,因此pH=6.8的溶液不一定显酸性,C不正确;D、碳酸的酸性强于稀硫酸次氯酸的酸性,因此根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO,D正确,答案选D。
考点:考查元素周期律的应用

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案下列有关元素的性质及其递变规律正确的是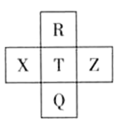
| A.Ⅰ A族元素与ⅦA族元素间形成的化合物一定含离子键 |
| B.第二周期元素从左到右,最高正价从+1递增到+7,最低负价从—4升高到—1 |
| C.同主族非金属元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱 |
| D.同周期主族金属元素的化合价越高,其原子失电子能力越强 |
下列说法中正确的是
| A.所有主族元素的正化合价数,等于它的族序数 |
| B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C.第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D.前三周期元素中共有非金属元素12种 |
右图为元素周期表中短周期的一部分,下列说法正确的是 
| A.非金属性:Y>Z>M |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.R氢化物的沸点高于Y氢化物的沸点 |
| B.R元素基态原子与W元素基态原子未成对电子数相同 |
| C.W与Y形成的化合物能与强碱溶液反应,但不能与任何酸反应 |
| D.R与Y形成的化合物和W与Y形成的化合物的晶体类型相同 |
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
| A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B.简单离子的半径:X > Z > M |
| C.由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z单质不能从M与R元素构成的盐溶液中置换出单质M |
同主族常见的三种元素X、Y、Z,它们最高价氧化物对应水化物的酸性强弱顺序为:HXO4<HYO4<HZO4,下列判断不正确的是
| A.Y单质可以在海水中提取 | B.离子半径: X->Y- |
| C.气态氢化物稳定性:HX<HZ | D.单质氧化性: Y>Z |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+ 与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
元素X形成的简单离子与钙离子的核外电子排布相同,且X的简单离子半径大于氯离子的半径,则X元素为
| A.Mg | B.S | C.Ar | D.K |