题目内容
右图为元素周期表中短周期的一部分,下列说法正确的是 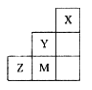
| A.非金属性:Y>Z>M |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
C
解析试题分析:由表判断,X、Y、Z、M分别为He、F、S、Cl。A、非金属性:Y>M>Z,错误;B、Y-电子层数少,半径小,M-、Z2-电子层数相同,质子数少,半径大,错误;C、根据元素原子最外层电子数和其显示的化合价数值是否为8判断是否满足8电子稳定结构,正确;D、F没有正价,错误。
考点:考查元素周期表与周期律有关问题。

下列各基态原子或离子的电子排布式错误的是
| A.Al 1s22s22p63s23p1 | B.S2- 1s22s22p63s23p4 |
| C.Na+ 1s22s22p6 | D.F 1s22s22p5 |
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
如图是元素周期表短周期元素的一部分。已知M最高价氧化物对应的水化物为常见的氧化性酸,下列说法正确的是: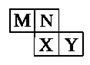
| A.M为氮元素 |
| B.原子半径:Y>X |
| C.氢化物沸点:X>N |
| D.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸 |
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
短周期元素W、X、Y和Z的原子序数依次增大,金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法正确的是
A.由金属W制备的高效电池可用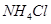 溶液作电解质 溶液作电解质 |
| B.元素Y、Z的最高价氧化物对应水化物之间可以发生反应 |
| C.元素X、Z形成的化合物为离子化合物 |
D.四种元素原子半径由大到小的顺序为: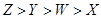 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述错误的是( )
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应